| |
|
|
 |
Riprendere l'ASA dopo un'ulcera emorragica? |
 |
 |
Inserito il 29 gennaio 2010 da admin. - gastroenterologia - segnala a:    
 Continuare l'ASA in pazienti che hanno avuto un'ulcera emorragica aumenta il rischio di recidiva ma, potenzialmente riduce la mortalità. Sono necessari trials più potenti per confermare questi dati.
Continuare l'ASA in pazienti che hanno avuto un'ulcera emorragica aumenta il rischio di recidiva ma, potenzialmente riduce la mortalità. Sono necessari trials più potenti per confermare questi dati.
Nei pazienti che hanno sviluppato un'ulcera peptica emorragica in corso di terapia con ASA a basse dosi è prudente, dopo la risoluzione dell'episodio, continuare con l'ASA stesso?
Per determinarlo è stato disegnato questo trail randomizzato e controllato, in cieco, contro placebo, di non inferiorità.
Sono stati reclutati 156 pazienti in trattamento con basse dosi di ASA per motivi cardiovascolari o cerebrovascolari e che avevano avuto un'ulcera emorragica trattata endoscopicamente. Immediatamente dopo la terapia endoscopica i partecipanti sono stati trattati con ASA 80 mg/die (n= 78) oppure con placebo (n= 78). In tutti i casi è stato somministrato pantoprazolo, in infusione nelle prime 72 ore ed in seguito per os. Lo studio è durato 8 settimane. L'endpoint primario era la recidiva di ulcera emorragica entro 30 giorni. Endpoint secondari erano la mortalità totale e specifica a 8 settimane.
Una recidiva di ulcera emorragica si ebbe entro 30 giorni nel 10,3% del gruppo ASA e nel 5,4% del gruppo placebo (aumento del rischio assoluto 4,9%; 95%CI da - 3,6% a 13,4%). Il limite superiore per la non inferiorità era di 10 punti percentuali pertanto lo studio non è riuscito a dimostrare la non inferiorità della ripresa dell'ASA dopo l'evento emorragico,
I pazienti trattati con ASA avevano una mortalità totale più bassa (1,3% versus 12,9%; differenza in punti percentuali = 11,6; 95%CI da 3,7 a 19,5 punti percentuali). I pazienti del gruppo ASA mostravano una minor mortalità per cause cardiovascolari e cerebrovascolari o per complicanze gastrointestinali rispetto ai pazienti del gruppo placebo.
Gli autori concludono che continuare l'ASA in pazienti che hanno avuto un'ulcera emorragica aumenta il rischio di recidiva ma, potenzialmente, riduce la mortalità. Sono necessari trials più potenti per confermare questi dati.
Fonte:
Sung JJY et al. Continuation of Low-Dose Aspirin Therapy in Peptic Ulcer Bleeding
A Randomized Trial. Ann Intern Med 2010 Jan 5; 152:1-9.
Commento di Renato Rossi
Lo studio di Sung e coll. purtroppo non permette conclusioni certe, sia perchè la casistica è poco numerosa, sia perchè la mortalità era un end point secondario, con tutti i limiti noti.
Tuttavia i suoi risultati sono probabilmente affidabili. E' noto infatti che i pazienti coronaropatici o vasculocerebropatici in trattamento con ASA che sospendono l'antiaggregante vanno incontro ad un aumento considerevole del rischio trombotico già dai primi giorni dopo la sospensione. Se è vero quindi che la reintroduzione precoce dell'ASA comporta un aumento del rischio di recidiva dell'ulcera emorargica è altrettanto vero che la non ripresa espone precocemente il paziente ad eventi trombotici cardiaci o cerebrali.
Quindi, come comportarsi?
Se l'ASA era stato prescritto in prevenzione primaria probabilmente può essere sospeso, tra l'altro considerando le recenti metanalisi che hanno fortemente posto in dubbio l'utilità di questa pratica, anche nei pazienti diabetici [1,2].
Se, invece, l'ASA era stato prescritto in prevenzione secondaria, il farmaco va ripreso non appena è stata raggiunta l'emostasi e comunque entro 7 giorni, associando un inibitore di pompa protonica a dosi piene. In questi casi è anche importante cercare un' eventuale infezione da Helicobacter Pylori e procedere con l'eradicazione. In alternativa all'ASA possono essere prescritti altri antiaggreganti, come per esempio la ticlopidina o il clopidogrel. Tuttavia alcuni studi hanno dimostrato che l'aggiunta di un PPI all'ASA è preferibile, in termini di eventi emorragici gastrici, al clopidogrel da solo in pazienti con pregressa emorragia da ASA [3,4]. Rimane da stabilire se sia praticabile l'alternativa di aggiungere un PPI al clopidogrel o alla ticlopidina. Da considerare, però, che dati recenti indicano che il PPI potrebbe ridurre l'attività antitrombotica del clopidogrel.
Commento di Alessandro Battaggia
Lo studio ha considerato 156 pazienti anziani in condizioni generali precarie (mortalità basale: 12.8% a 8 settimane) in terapia con aspirina a basse dosi per profilassi o terapia di situazioni cardiovascolari afferenti alle strutture ospedaliere per ematemesi o melena. Una volta sottoposti a cicatrizzazione endoscopica della lesione emorragica 78 pazienti furono randomizzati a prosecuzione della terapia antiaggregante con aspirina (80 mg) + IPP e 78 pazienti furono assegnati a placebo. Il follow-up comprendeva una rivalutazione endoscopica a 30 e a 56 giorni.
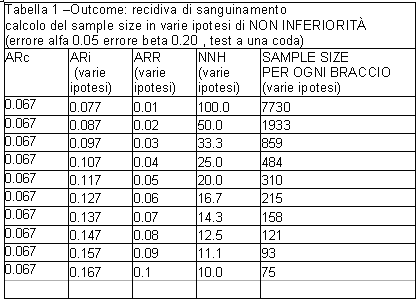
Il sample size è stato testato -ad una potenza statistica dell’ 80% e ad un errore alfa del 5% utilizzando un test ad una coda- su una ipotesi di non inferiorità.
Il trattamento asa+IPP sarebbe stato infatti definito ‘non inferiore’ rispetto al placebo qualora l’ incidenza di recidive emorragiche (outcome primario) non fosse risultata superiore di 10 punti percentuali rispetto al placebo (intervallo di equivalenza= 10 punti percentuali in termini di differenza in rischio assoluto ARR). Più in dettaglio, l’ ipotesi di non superiorità sarebbe stata soddisfatta qualora l’ estremo superiore dell’ intervallo di confidenza della stima di ARR non avesse superato oltre dieci punti percentuali la frequenza dell’ evento (ARc) rilevata nel braccio di controllo. Per il calcolo del sample size gli autori hanno ipotizzato una frequenza basale di recidiva emorragica pari a ARc=6.7%
Le percentuali di sanguinamento riportate dallo studio sono 10.3% nel braccio aspirina+IPP e 5.4% nel braccio placebo (P calcolabile dal confronto= 0.22).
La differenza in rischio assoluto riportata dagli autori risulta ARR= 4.9%(IC 95%:-3.6%13.4%).
L’ estremo superiore degli intervalli di confidenza (ARR=13.4%) supera così il cut off di ARR=10% che definisce il rispetto dell’ ipotesi di ‘non inferiorità’.
NB: queste percentuali risultano peraltro leggermente diverse da quelle calcolabili in base ai dati riportati dalla tabella 2, in quanto 8/78=0.102=10.2% e rispettivamente 4/78=0.051=5.1%.
Gli autori riportano un rischio assoluto di morte pari a 1.3% nel braccio aspirina+IPP e a 12.9% nel braccio assegnato a placebo (ARR = 11.6% Ic95% 3.7%-19.5%).
In base ai dati così presentati gli autori concludono che “nei pazienti trattati con asa a basse dosi che subiscono eventi emorragici la prosecuzione della terapia a base di aspirina sotto gastroprotezione può aumentare il rischio di emorragie recidive ma è potenzialmente in grado di ridurre i tassi di mortalità”.
Commento
1) Scelta opinabile del range dell’intervallo di non inferiorità
Può essere osservato che basare una ipotesi di ‘non inferiorità’ su un cut off che corrisponde ad una differenza di rischio tra i due bracci pari a dieci punti percentuali appare molto azzardato, perché equivale, implicitamente, a considerare ‘accettabile’ sotto il profilo clinico una probabilità di recidiva emorragica pari a un paziente ogni 10 trattati con aspirina+IPP anziché con placebo (al cut off di ARR = 10% NNH=10, vedi tabella 1).
Evidentemente il principio ispiratore della scelta è stata la necessità di arruolare il numero più basso possibile di pazienti (vedi tabella 1 a valori di ARR=0.10).
2) La numerosità campionaria è coerente all’ ipotesi formulata
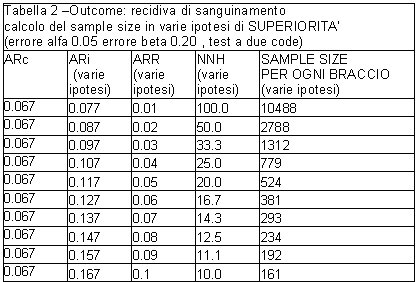
Gli autori hanno dichiarato assenza di non inferiorità del rischio di complicanze emorragiche nel braccio assegnato ad aspirina+IPP rispetto a placebo in quanto il limite superiore dell’intervallo di confidenza di ARR ha superato il cut off di 10 punti percentuali che definivano “l’intervallo di non inferiorità”. Affermare come fatto - che il campione ‘è troppo piccolo’ per le conclusioni primarie non sembra però avere senso in quanto il sample size (78 pazienti per braccio programmati per l’ipotesi di non inferiorità) ha in realtà rispettato la quantità di errore alfa (0.05) e di errore beta (0.20) programmato dal protocollo sotto questa ipotesi.
Il campione sarebbe stato invece ‘troppo piccolo’ per dimostrare la differenza osservata qualora il sample size fosse stato programmato in base a un’ipotesi di superiorità (vedi tabella 2 a valori di ARR=0.10). perché in tal caso sarebbero stati necessari almeno 161 pazienti per braccio.
3) La numerosità campionaria non è stata tarata sull’outcome ‘mortalità’
Le osservazioni sulla minor incidenza di casi mortali nel braccio trattato con aspirina+IPP appaiono incongrue.
Infatti la mortalità generale in questo studio è un outcome secondario, e non è su questo risultato che è stata tarata la numerosità del campione.
Attribuendo ai risultati che si riferiscono a questo end-point la stessa dignità di un’analisi primaria gli autori incorrono in un aumentato rischio di errore di tipo I legato a confronti multipli eseguiti sullo stesso campione: vale a dire che, indipendentemente dalla ‘significatività statistica’ rilevata nominalmente per l’end-point ‘mortalità, l’ esecuzione di più confronti sullo stesso campione non esclude il rischio che quanto rilevato sia in realtà dovuto al caso.
Se il sample size fosse stato tarato sull’outcome ‘mortalità la numerosità campionaria necessaria a dimostrare le differenze osservate tra i due bracci (ai livelli di errore alfa e di errore beta programmati) avrvebbe dovuto essere pari a 95 soggetti per braccio.
4) La numerosità campionaria non è sufficiente per le conclusioni finali
Affermare pertanto che “aspirina+IPP fa sanguinare di più” in base all’accettazione dell’ ipotesi nulla in una valutazione di non inferiorità per l’outcome ‘sanguinamento’ (BOX 2), ma che “in compenso aspirina+IPP riduce la mortalità generale” in base alla ricusazione della ipotesi nulla in una valutazione di superiorità per l’outcome ‘mortalità’ (BOX 1) non ha quindi alcun senso in quanto il rispetto di queste conclusioni avrebbe dovuto essere impostata sull’ analisi di una casistica rappresentata da un campione più ampio di 75+75+95+95= 340 pazienti, ossia oltre il doppio di quelli reclutati.
Box 1: Studi di superiorità
Uno studio controllato “di superiorità” (la maggioranza delle ricerche che arrivano all’attenzione dei medici) si propone di dare una risposta al quesito: “il farmaco A ha una efficacia diversa rispetto al farmaco B?”. L’analisi statistica dei risultati permette di accettare o ricusare l’ipotesi nulla, ossia che “la differenza rilevata tra i due bracci sia solo spiegata dal caso”. Il test statistico esprime con il valore di P la probabilità esatta di questa circostanza, ossia che la differenza riscontrata sia solo casuale. Se questa probabilità è trascurabile l’ipotesi nulla viene ricusata e si è autorizzati ad affermare che la differenza tra i due bracci non è casuale. Si definisce per convenzione “trascurabile” una probabilità di risultati casuali inferiore al 5% (P<0.05). Se viceversa la probabilità di un risultato casuale è superiore al 5% (P>0.05) l’ipotesi nulla viene accettata e si definisce la differenza riscontrata tra i due bracci ‘non significativa’ ossia non imputabile ad una reale diversità di efficacia essendo solo spiegata dal caso. E’ importantissimo ricordare che il riscontro di una differenza “non significativa” non autorizza ad affermare che i trattamenti sono “equivalenti”: aumentando le dimensioni campionarie qualsiasi differenza anche minima tra i due bracci diventerebbe “significativa”.
Box 2: Studi di equivalenza (gli studi di non inferiorità ne rappresentano una variante)
Uno studio controllato “di equivalenza” si propone di dare una risposta al questito: “il farmaco A ha una efficacia equivalente al farmaco B?”.
In questo caso l’ipotesi nulla è rovesciata, ossia si parte dal presupposto che “i due trattamenti non siano equivalenti”.
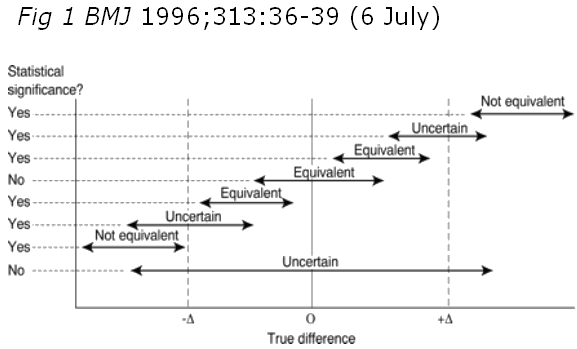
Negli studi di equivalenza deve essere esplicitato cosa gli autori intendano per “equivalenza”, in quanto si tratta di un concetto clinico e non statistico. E’ chiaro che se il farmaco A è “equivalente” al farmaco B e ciò viene verificato in uno studio controllato, le differenze tra un braccio e l’altro dovranno essere molto piccole. Ma quanto piccole? Ciò deve essere stabilito ex ante dal protocollo dello studio, vale a dire che gli autori devono indicare un range di valori della misura di efficacia che esprime il confronto tra i due bracci (= “intervallo di equivalenza”) entro cui per parlare di “equivalenza” deve necessariamente cadere la stima del risultato di efficacia che esprime il confronto. Entro questo range “di equivalenza”, più precisamente, deve cadere non solo la stima del risultato del confronto ma anche il suo intervallo di confidenza che esprime appunto la precisione della stessa stima. Ancora più in dettaglio (vedi fig. 1) la condizione di “equivalenza” è caratterizzata dal fatto che i limiti estremi dell’intervallo di confidenza della misura di efficacia che esprime il confronto tra i due bracci devono cadere entro il range dell’intervallo di equivalenza predefinito. In caso contrario i due trattamenti non potranno essere considerati “equivalenti”.
Referenze
1. http://www.pillole.org/public/aspnuke/news.asp?id=4675
2. http://www.pillole.org/public/aspnuke/news.asp?id=4856
3. http://www.pillole.org/public/aspnuke/news.asp?id=1581
4. Lai KC et al. Esomeprazole with aspirin versus clopidogrel for prevention of recurrent gastrointestinal ulcer complications. Clin Gastroenterol Hepatol. 2006;4:860-5.
|
 |
 |
Letto : 3849 | Torna indietro |  | |  | | 
|
 |
 |
 |
 |
|
|
|


