| |
|
|
 |
Polimorfismo del citocromo P450 influenza grandemente la tossicità dei FANS |
 |
 |
Inserito il 11 giugno 2008 da admin. - reumatologia - segnala a:    
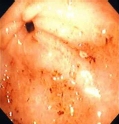 Alcuni polimorfismi del gene del CYP2C9 possono identificare sottogruppi di pazienti a rischio molto elevato di sanguinamento gastroenterico quando trattati in acuto con farmaci antinfiammatori metabolizzati dal CYP2C9.
Alcuni polimorfismi del gene del CYP2C9 possono identificare sottogruppi di pazienti a rischio molto elevato di sanguinamento gastroenterico quando trattati in acuto con farmaci antinfiammatori metabolizzati dal CYP2C9.
Molti antinfiammatori non steroidei, sia COX selettivi che non selettivi, sono metabolizzati dall'isoenzima P450 2C9 (CYP2C9). Due varianti (CYP2C9*2 and *3) comuni del gene del CYP2C9 incidono sull'attività dell'enzima. Al fine di valutare l'impatto del polimorfismo del CYP2C9 sul rischio di sanguinamento gastroenetrico in utlizzatori in acuto di FANS.
Trattasi di uno studio caso-controllo su 26 pazienti con sanguinamento da FANS endoscopicamente confermato e 52 soggetti di controllo senza lesioni endoscopiche appaiati per età. sesso ed uso di FANS. Sia i casi che i controlli erano HP negativi ed avevano assunto antinfiammatori non steroidei metabolizzati dal CYP2C9 ( celecoxib, diclofenac, ibuprofene, naprossene o piroxicam).
In tutti i soggetti sono stati studiati 2 polimorfismi del gene CYP2C9 corrispondenti agli alleli CYP2C9 *2 e *3 . Considerando il CYP2C9*1/*1 quale variante tipo selvaggia, frequenze significativamente più elevate del CYP2C9*1/*3 (34.6% vs 5.8%; P < .001; OR 12.9; 95% CI da 2.917 a 57.922) e del CYP2C9*1/*2 (26.9% vs 15.4%; P = .036; OR, 3.8; 95% CI da 1.090 a 13.190) sono state identificate nei pazienti con sanguinamento rispetto a quanto osservato nei controlli, mentre non sono state rilevate differenze per quanto concerne la condizione di eterozigosi del CYP2C9*2/*3. Considerando i portatori degli alleli, la presenza dell'allele CYP2C9*3 con un aumentato rischio di sanguinamento (adjusted OR, 7.3; 95% CI da 2.058a 26.004).
Gli Autori concludono che che studiare il genotipo del CYP2C9 può identificare sottogruppi di pazienti a maggior rischio di sanguinamento quando trattati in acuto con farmaci antinfiammatori metabolizzati dal CYP2C9, ma ulteriori studi sono necessari per verificare l'efficacia sul campo di una strategia di tipizzazione del CYP2C9 prima di raccomandarla nella pratica clinica.
Fonte: Gastroenterology. 2007 Aug;133(2):465-71
Molti farmaci vengono metabolizzati dal sistema epatico del citocromo P450, costituito da una serie di isoenzimi localizzati sulle membrane microsomiali del reticolo endoplasmatico liscio principalmente a livello epatico e/o in tessuti extraepatici, quali il tratto gastrointestinale, i reni, i polmoni, la cute ed il sistema nervoso centrale. Tutte le isoforme enzimatiche del citocromo P450 sono proteine contenenti un gruppo eme che sono suscettibili a subire processi di inibizione ed induzione enzimatica. Nel caso dell’inibizione due o più farmaci essendo metabolizzati dallo stesso enzima si determina una competizione di legame con diminuzione della metabolizzazione del farmaco con minore affinità. I meccanismi di inibizione degli enzimi CYP450 in base all'interazione che si instaura tra enzima e substrato (farmaco o suoi metaboliti) possono essere suddivisi in tre categorie: reversibili, quasi-irreversibili ed irreversibili (3). Alcuni farmaci e ed altre sostanze esogene (es. fenobarbitale, carbamazepina, fenitoina, etanolo, fumo di sigaretta, succhi di frutta, alcol, caffé, té) sono invece in grado di indurre, sia a livello epatico che extraepatico, diversi CYPs, tra cui il CYP 1A1, 1A2, 2C9, 2E1, 3A4. Mentre l'inibizione è immediata, l’induzione è un processo lento, tempo-dipendente. Le conseguenze più importanti della induzione dei CYPs nella terapia farmacologica sono:
a) una riduzione degli effetti farmacologici in seguito ad un incremento del metabolismo del farmaco;
b) una diminuzione della tossicità, attraverso una detossificazione più rapida,
c) un aumento della tossicità, in seguito alla maggiore produzione di metaboliti reattivi.
Gli isoenzimi del citocromo P450 sono stati suddivisi in famiglie e sottofamiglie, in base alla somiglianza strutturale nella sequenza aminoacidica, ed indicati con il prefisso CYP seguito da un primo numero indicante la famiglia, una lettera indicante la sottofamiglia ed un secondo numero indicante il singolo isoenzima. Negli ultimi anni sono stati identificati circa 30 CYPs, 7 dei quali svolgono un ruolo determinante nel metabolismo dei farmaci (CYP 1A2, 2C8, 2C9, 2C19, 2D6, 3A4, 2E1). Esiste una certa variabilità interindividuale nel contenuto e nell’attività di diversi enzimi del citocromo P450. Tra i molteplici fattori responsabili di tale fenomeno, il polimorfismo genetico è sicuramente il più importante (3).
Pertanto a diversi isoenzimi corrispondono capacità metaboliche diverse.
Un’utilissima tabella dei substrati, degli induttori e degli inibitori delle varie isoforme e dei farmaci che vengono metabolizzati si trova sul sito dell'Università dell'INDIANA
http://medicine.iupui.edu/flockhart/table.htm
E' risaputo che i FANS siano gravati da effetti collaterali a livello gastroenterico tanto che si è cercato di ridurre il rischio con l'introduzione di farmaci selettivi sull’isoforma COX della ciclossigenasi. Sono stati proposti numerosi algoritmi per cercare di stratificare il rischio di complicanze gastroenteriche in base a diversi fattori tra cui i più importanti sono l'età, la comorbidità l'utilizzo di contemporaneo di più FANS, la storia di ulcera o di precedenti eventi a livello gastroenetrico, l'impiego contemporaneo di steroidi e di warfarin. Tali scale del rischio tuttavia presentano notevoli margini di incertezza e pertanto il valore predittivo non è elevato. Mancano dunque uno o più "fattori X" per spiegare quanto non si riesce a predire impiegando gli algoritmi del rischio gastroenterico maggiormente accreditati.
Lo studio in questione si propone di identificare uno dei "fattori X" . La spiegazione della varianza residua "inspiegata" applicando le carte del rischio" di tossicità g-i per l'impiego dei FANS potrebbe risiedere proprio nel polimorfismo del CYP2C9.
Lo studio essendo stato fatto su piccoli numeri presenta ampi intervalli di confidenza, dunque è interessante, ma non può fornire risposte definitive. Uno studio olandese su 26 soggetti non aveva trovato differenze nei polimorfismi del CYP2C9 tra i soggetti con complicanze da FANS e soggetti di controllo che erano in terapia con warfarin (1).
Certamente la magnitudo dei valori puntuali degli OR appare impressionante, pertanto se il ruolo del polimorfismo del CYP2C9 sulla tossicità g-i da FANS venisse confermato questo fattore rischierebbe di pesare assai di più rispetto ad altri che sono considerati da tutte le carte del rischio g-i da FANS.
Questo rafforzerebbe la necessità di valutare con estrema prudenza tutti i vari studi retrospettivi sulla tossicità G-I dei FANS e dei COXIB metabolizzati CYP2C9 poiché se una tale variabile con questa forza non fosse equamente distribuita tra i vari gruppi considerati creerebbe uno sbilanciamento di tale entità da rendere praticamente impossibile l'analisi dei dati a meno che non si operasse un’analisi di sensibilità considerando anche fattori esercitanti effetti di tale entità. Ecco la necessità di affidarsi agli studi randomizzati in cui la probabilità che eventuali "fattori X" siano distribuiti in modo pesantemente diverso tra i due gruppi è resa remota proprio dalla randomizzazione.
Occorre inoltre notare che il polimorfismo del CYP2C9 influenza pure la variabilità dell’attività anticoagulante allorquando gli antinfiammatori vengono usati assieme al warfarin, come dimostrato dai risultati di uno studio (2) in cui si è osservato che l’ incremento di incidenza dell’INR oltre 6 è stato di 2.98 (95%; CI da 1.09 a 7.02) nei pazienti trattati con FANS e warfarin portatori dell’allele CYP2C9*2 e 10.8 (95%; CI da 2.57 a 34.6) nei portatori dell’allele CYP2C9*3 rispetto ai soggetti non portatori di tali alleli.
Referenze
1) Clin Ther. 2006 10:1670-6
2) Clin Pharmacol Ther. 2005;77(6):479-85
3) Gabriella Facciolà, Maria Gabriella Scordo: Citocromo P450 e interazioni tra farmaci. http:// http://www.farmacovigilanza.org/corsi/facciola/all.htm
|
 |
 |
Letto : 5024 | Torna indietro |  | |  | | 
|
 |
 |
 |
 |
|
|
|


