 |
 |
 |
 |
 |
| |
|
|
 |
Alcune Società scientifiche chiedono di rivedere la sospensione della sibutramina |
 |
 |
Inserito il 01 febbraio 2010 da admin. - metabolismo - segnala a:    
 La decisione di sospendere la sibutramina sulla base dello studio SCOUT è da rivedere secondo alcune società scientifiche che si occupano di obesità e nutrizione.
La decisione di sospendere la sibutramina sulla base dello studio SCOUT è da rivedere secondo alcune società scientifiche che si occupano di obesità e nutrizione.
Premessa
La sibutramina è stata recentemente sospesa in ambito comunitario ma avevamo già sottolineato che questa decisione appariva quanto meno singolare poichè presa sulla base di risultati di uno studio (SCOUT) in cui una vasta parte di pazienti arruolati aveva controindicazioni all'assunzione della sibutramina. http://www.pillole.org/public/aspnuke/news.asp?id=4946
Adesso tre Società scientifiche che si occupano di obesità e nutrizione chiedono che tale decisione sia rivista alla luce del fatto che gli eventi in eccesso del braccio sibutramina dello studio SCOUT si sono verificati prevalentemente proprio nei pazienti in cui il farmaco era controindicato: i diabetici con malattia cardiovascolare.
Studio scout e ritiro di siburamina: il parere congiunto di SIO-ADI-ANSISA
Studio SCOUT e sibutramina : un precedente inquietante
A cura della Società Italiana dell’Obesità, dell’Associazione Italiana di Dietetica e Nutrizione Clinica, dell’Associazione Nazionale Specialisti in Scienza dell’Alimentazione
Recentemente, la Food and Drugs Administration (FDA) ha lanciato un allarme per i dati emersi dallo studio SCOUT (Sibutramine Cardiovascular Outcome) 1; i dati preliminari di questo studio indicherebbero una più alta incidenza di eventi cardiovascolari (infarto miocardico, ictus, arresto cardiaco o morte) nei pazienti trattati con sibutramina rispetto a coloro che assumevano placebo. Analizzando gli stessi dati l’ Agenzia Europea dei Medicinali (EMEA) ha deciso di sospendere dal mercato il farmaco2. Lo studio SCOUT fu richiesto dall’EMEA come condizione per la commercializzazione del farmaco nell’Unione Europea3. Lo studio ha incluso circa 10.000 pazienti arruolati per un periodo massimo di sei anni.
Al fine di garantire la sicurezza dei pazienti, ogni sei mesi un board indipendente che faceva riferimento all’EMEA controllava i dati. Questo studio prevedeva l’arruolamento di soggetti con accertate controindicazioni all’uso del farmaco. A causa del basso numero di eventi, inferiori rispetto all’atteso, dopo quindici mesi dall'inizio dello studio, i criteri di inclusione sono stati resi ancora più restrittivi e i pazienti dovevano presentare sia malattie cardio-vascolari sia diabete mellito 4. Dai dati preliminari pubblicati sul sito della FDA si nota come proprio solo in quest’ultimo sottogruppo vi sia una differenza statisticamente significativa di eventi avversi tra il farmaco e il placebo, mentre nel sottogruppo di pazienti con solo DM o solo CVD non vi siano differenze statisticamente significative 5.
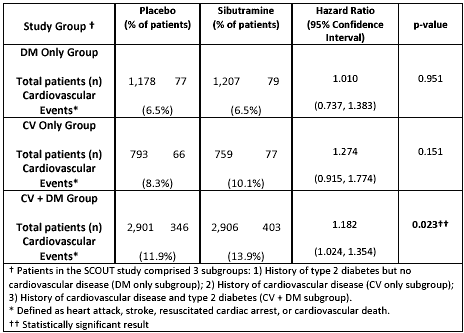
Emergerebbe quindi che la sibutramina non è in grado di modificare il rischio cardiovascolare quantomeno nei soggetti diabetici e che solo la coesistenza di due importanti fattori di rischio, diabete e patologia cardiovascolare nota, ha un effetto negativo sul rischio cardiovascolare stesso. Poiché l’impiego di sibutramina è sempre stato controindicato nei soggetti con patologia cardiovascolare nota, questi dati non fanno che confermare il profilo di sicurezza del farmaco nei soggetti nei quali non è controindicato.
Questo è il primo studio al mondo dove, per valutare la sicurezza di un farmaco, dopo la sua immissione sul mercato, si siano sottoposti a un trattamento farmacologico un numero così elevato di soggetti con chiare controindicazioni al farmaco stesso e per un periodo di tempo fino sei volte superiore a quello approvato (in Europa, la sibutramina è registrata per un anno di terapia continuativa). In effetti molti comitati etici non hanno ritenuto di approvare lo studio in considerazione del fatto che i criteri di arruolamento prevedevano l’inclusione di pazienti a rischio cui il farmaco era controindicato. Il disegno dello studio, così come concepito, era di verificarne la sicurezza del farmaco in soggetti con assolute controindicazioni. Trasferire i risultati di questo studio come valutazione di efficacia e di sicurezza del farmaco in pazienti obesi non complicati è discutibile. Si sottolinea inoltre il danno incalcolabile che deriva dalla mancata possibilità di trattare pazienti con precise indicazioni al farmaco e per le quali il farmaco era stato regolarmente autorizzato e messo in commercio.
Curare l’obesità, nelle strutture deputate a questa e negli ambulatori dedicati, sarà più difficile perché si priva il medico di un efficace molecola che poteva aiutare il paziente nel lungo percorso delle modifiche dello stile di vita. Nessun farmaco antiobesità ad azione centrale è così ricco di letteratura nella storia della medicina. E’ poi importante sottolineare che la sibutramina è, al pari di altre molecole regolarmente in commercio, una molecola che inibisce la ricaptazione di serotonina e noradrenalina.
In termini più specificatamente riguardanti l’ambito terapeutico cui la sibutramina si inserisce e cioè la terapia dell’obesità, sembra esistere un preconcetto che non ha pari in altre patologie e che deriva dal considerare l’obesità una patologia benigna o una non patologia a fronte di una montante evidenza che le attribuisce un ruolo fondamentale nella genesi di malattie quali il diabete, la malattia cardiovascolare ischemica e alcune neoplasie. Chiediamo di rivalutare l’intera vicenda ( anche alla luce di quanto espresso non solo dall’Agenzia Europea ma anche dalla FDA ) soprattutto quando saranno disponibili i dati completi dello studio
SCOUT.
Riferimenti Bibliografici
1 Meridia (sibutramine hydrochloride): Early Communication about an Ongoing Safety Review. FDA Safety Information. 20 November 2009
http://www.fda.gov/Safety/MedWatch/SafetyInformation/SafetyAlertsforHumanMedicalProducts/ucm191655.ht
m
2 http://www.ema.europa.eu/pdfs/human/referral/sibutramine/Sibutramine_Q&A_80817909en.pdf
3 http://www.emea.europa.eu/pdfs/human/referral/sibutramine/451402en.pdf
4 Torp-Pedersen C, Caterson I, Coutinho W et al. Cardiovascular responses to weight management and sibutramine in high-risk subjects: an analysis from the SCOUT trial. Eur Heart J. 2007 Dec;28(23):2915-23. (full text)
5 Follow-Up to the November 2009 Early Communication about an Ongoing Safety Review of Sibutramine, arketed as Meridia.
http:////www.fda.gov/Drugs/DrugSafety/PostmarketDrugSafetyInformationforPatientsandProviders/DrugSafetyInforationforHeathcareProfessionals/ucm198206.htm
Hanno collaborato alla stesura : Luca Busetto,Saverio Cinti, Gianleone Di Sacco, Giuseppe Fatati, Fabrizio Muratori, Renato Pasquali, Maria Letizia Petroni, Carlo Maria Rotella,Giuseppe Rovera, Roberto Vettor, Federico Vignati.
|
 |
 |
Letto : 3019 | Torna indietro |  | |  | | 
|
 |
 |
 |
 |
|
|
|
© Pillole.org 2004-2025 | Disclaimer | Reg. T. Roma n. 2/06 del 25/01/06 | Dir. resp. D. Zamperini 
ore 19:48 | 114091193 accessi| utenti in linea:
40627
|
| |


