
Gli screening
Data : 13 gennaio 2007
Autore : admin
Pagina: 1 - concetti base
E’ utile diagnosticare una malattia solo se abbiamo modo di guarirla o comunque di cambiarne in meglio la storia naturale. La diagnosi precoce in se non giustifica un programma di screening. È utile diagnosticarla precocemente solo se queste due evenienze sopra diventano significativamente più probabili. Non serve, anzi è dannosa, la diagnosi precoce di una malattia che non può essere curata o guarita. Infatti, poiché si anticipa la diagnosi, si ha aumento di sopravvivenza anche senza modificare la storia naturale della malattia (lead time bias). Inoltre con lo screening si trova una proporzione maggiore di casi ad evoluzione lenta, di solito meno aggressivi, e con una probabilità di sopravvivenza maggiore (length bias). Gli screening oncologici per i quali l’efficacia è sufficientemente provata, ma non senza controversie residue, riguardano il cervicocarcinoma, il tumore della mammella e il tumore del colon retto. Finora non sono disponibili evidenze sufficienti per lo screening del tumore della prostata, a dispetto del largo uso inappropriato che si fa del test del PSA, per lo screening del tumore del polmone, a dispetto della disponibilità di un esame molto sensibile con la CT spirale, né per altri tumori.
Ogni intervento sanitario ha o può avere effetti negativi. Cercare una malattia, in assenza di sintomi, con mezzi diagnostici sempre più sensibili significa inevitabilmente aumentare il numero di casi falsi positivi. Dei falsi positivi preoccupano non solo i costi economici e il sovraccarico dei servizi diagnostici derivante da esami che a posteriori si riveleranno inutili, ma ancora di più i costi personali (danni fisici da esami invasivi, ansia in attesa della diagnosi, stigma di anormalità e di alto rischio, ridotta adesione ad inviti successivi). Ecco perché si deve mantenere la massima attenzione alla specificità. Più il test è sensibile maggiore sarà anche il numero di casi sovradiagnosticati, quelli cioè che non sarebbero altrimenti arrivati all’osservazione clinica a causa di un decorso molto lento e asintomatico o di una regressione spontanea. Il fatto che una neoplasia regredisca e guarisca spontaneamente viene normalmente considerato un’evenienza eccezionale, mentre – ad esempio – avviene in oltre la metà dei casi di carcinoma in situ della cervice uterina. L’esempio dell’elevata sovradiagnosi di tumore della prostata mostra quanto sia importante una chiara comprensione della storia naturale di un tumore e il completamento degli studi di efficacia prima di proporre uno screening quale intervento di popolazione.
È ampiamente provato che se non si adottano misure attive per un coinvolgimento della popolazione e non si pone attenzione specifica all’accessibilità, finiscono per utilizzare lo screening solo una parte dei beneficiari potenziali. Tale parte, paradossalmente, è costituita da persone con rischio inferiore alla media e già molto attente alla loro salute, mentre tendono a rimanere esclusi coloro che maggiormente ne beneficerebbero.
Pagina: 2 - lo screening ideale
Caratteristiche di un ideale programma di screening
Caratteristiche della malattia
Impatto significativo sulla salute pubblica
Periodo asintomatico durante il quale la scoperta è possibile
Esiti migliorati dal trattamento durante il periodo asintomatico
Caratteristiche del test
Sufficientemente sensibile da rilevare la malattia durante il periodo asintomatico
Sufficientemente specifico da minimizzare i falsi positivi
Accettato dai pazienti
Caratteristiche della popolazione screenata
Sufficientemente alta prevalenza della malattia che giustifichi lo screening
Sistema Sanitario in grado di provvedere ai programmi e relativa cura
Pazienti disposti ad adeguarsi al programma e al successivo trattamento
Per stabilire se uno screening è utile o no si usano i criteri di Wilson e Junger adottati dalla OMS
1. E’ la malattia un’importante problema di sanità pubblica?
2. Esiste un efficace trattamento per la malattia localizzata?
3. Esistono strutture per la diagnosi e il trattamento?
4. Esiste uno stadio latente identificabile o uno stadio sintomatico precoce della malattia?
5. La tecnica dello screening è efficiente?
6. I test sono accettabili per la popolazione?
7. La storia naturale della malattia è conosciuta?
8. Esiste una strategia per determinare quali pazienti sarebbero trattati o no?
9. Il costo dello screening è accettabile?
10. Il trattamento disponibile è efficace e la gestione dei casi in stadio precoce ha un
impatto favorevole sulla prognosi?
Pagina: 3 - i bias
Quando si analizzano i risultati di uno screening occorre tenere in considerazione alcuni bias (vizi) che possono inficiare i risultati stessi. Vediamo i più importanti.
Uno studio ha comparato la mortalità malattia-specifica con la mortalità per tutte le cause negli studi randomizzati per interventi di screening. La mortalità malattia-specifica è l’end point fondamentale universalmente accettato negli studi randomizzati degli screening dei tumori. La validità di questo end point si basa sull’assunzione che la causa di morte può essere determinata accuratamente. Questa assunzione è stata messa in discussione da molti studi per via dell'accuratezza dei certificati di morte ed anche questo studio la mette in discussione La mortalità per tutte le cause, al contrario, non richiede valutazioni sulla causa di morte. Inoltre, la mortalità per tutte le cause è una misura che può catturare effetti letali ed inaspettati della cura medica. Esempi sono gli interventi sul cuore che possono causare morti non dovute a cause cardiache, da qui l’idea di usare tutte le cause di mortalità come end point nei trials per farmaci per il cuore. Sono stati trovati 16 trials randomizzati per mortalità malattia specifica. Otto riguardavano lo screening per il tumore al seno con mammografia, tre lo screening colon rettale con sangue occulto fecale e cinque lo screening per il tumore polmonare con Rx Torace.
Sono stati esclusi quattro lavori perché mancanti dei dati sulla mortalità per tutte le cause o perché era impossibile calcolarli, lo Stockholm mammographic screening trial, il London mass radiology trial, il Johns Hopkins study, e lo studio del Memorial Sloan-Kettering. Così sono stati considerati per l’analisi 12 studi per i quali era possibile calcolare la mortalità malattia-specifica e la mortalità per tutte le causee; sette per la mammografia, tre per il sangue occulto fecale e due per la Rx del Torace.
Pagina: 4 - Sticky-diagnosis
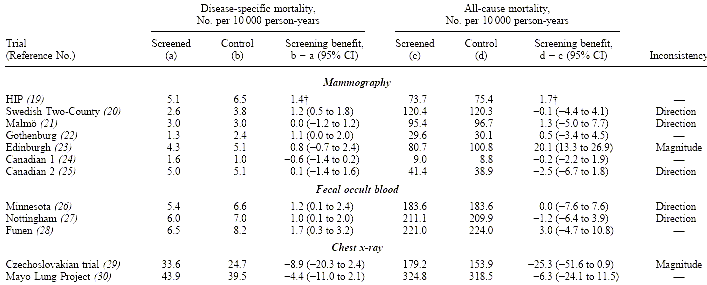
Il calcolo è basato sul numero di morti per 10.000 persone-anno di osservazione e per ciascun RCT è usato lo stesso denominatore per la mortalità specifica e per tutte le cause.
L’autore afferma che l’uso della mortalità per malattia specifica come end point primario espone l’analisi dello screening a 2 forme di bias seri:
1) Sticky-diagnosis bias (vizio di diagnosi complessa) dove le morti di incerta causa nel gruppo di screening sono erroneamente attribuite al cancro specifico o le morti nei controlli sono erroneamente attribuite ad altre cause. Questo bias favorisce il gruppo di controllo.
Pagina: 5 - Slippery-linkage
2) Slippery-linkage bias (vizio di associazione ingannevole) dove le morti dovute a interventi diagnostici o terapeutici che sono promossi dallo screening (esempio perforazione del colon o morte cardiaca) non sono attribuite allo screening. Si veda anche gli effetti della Radioterapia nell’incrementare le morti per altre cause (2). Questo bias tende a favorire il gruppo dello screening.
Se si usano le morti per tutte le cause si evitano questi bias, ma occorre un campione di persone enorme. Ad esempio se si assume una potenza dell’80% e un tipo di errore a una taglia del 2,5% avremo che per uno studio che come end point sia la morte per tumore avremo una popolazione di 150.000 mentre uno studio con end point primario tutte le cause di mortalità avremo un campione di 4,1 milioni. L’autore suggerisce che l’effetto netto di questi bias ha favorito gli screening in quanto lo slippery linkage bias è più importante che lo sticky diagnosi bias.
In ogni studio di screening il rischio della popolazione screenata di morire della malattia oggetto dello studio è bassa. Anche se lo screening è efficace un enorme numero di persone deve essere valutato e tra queste altre saranno trattate per salvare una vita dal cancro. Così ci può essere un bilanciamento fine tra beneficio e danno dello screening.
Questo articolo rafforza i risultati del controverso articolo di Gotzsche e Olsen in cui solo 2 degli otto trials di screening mammografici vennero considerati di sufficiente qualità portando gli autori a dimostrare che non c’era beneficio per gli screening mammografici. Allora una critica che era stata fatta era l’enfasi che i due autori facevano della mortalità per tutte le cause.
Pagina: 6 - varie combinazioni
Tabella. Interpretazione delle varie combinazioni tra morti per malattia specifica e tutte le cause di mortalità.
Gli autori concludono che la mortalità per malattia specifica potrebbe far perdere i benefici dello screening per erronea classificazione delle cause di morte. Perciò questo end point dovrebbe essere sempre valutato insieme a tutte le cause di mortalità. Inoltre la riduzione della mortalità per malattia specifica non dovrebbe essere considerata come una forte evidenza di efficacia quando la mortalità per tutte le cause è la stessa o più alta nel gruppo di screening.
SCREENING BIAS
Screening bias (un tipo di bias di selezione) capita perchè i soggetti che volontariamente si sottopongono allo screening tendono ad essere più sani che i controlli che non si sottopongono allo screening con una più bassa percentuale di mortalità non per la malattia in questione ma per tutte le cause di mortalità. Così un beneficio osservato potrebbe non essere dovuto allo screening ma semplicemente ad una autoselezione di una coorte di volontari più sani, come ad esempio lo studio Canadese.
Pagina: 7 - lead time bias
LEAD-TIME (periodo di tempo complessivo dall’inizio alla fine) BIAS
Lead-time bias capita quando il periodo asintomatico nella storia naturale della malattia non viene tenuto in conto. Per esempio assumiamo che una malattia è 100% fatale con un periodo medio di sopravvivenza di 3 anni dal tempo della comparsa dei sintomi e un periodo asintomatico di 4 anni. In una popolazione non screenata la diagnosi sarà basata sui sintomi clinici e il tempo medio dalla diagnosi alla morte sarà di 3 anni. Al contrario in una popolazione screenata la diagnosi sarà fatta durante il periodo asintomatico, in media 2 anni prima della comparsa dei sintomi. Il tempo dalla diagnosi alla morte sarà ora di 5 anni (2 anni del periodo asintomatico + 3 anni del periodo sintomatico.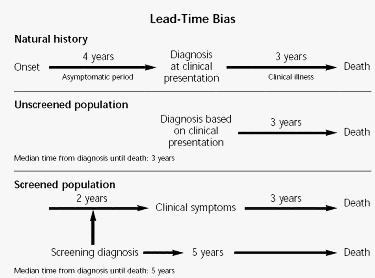
Quando le due popolazioni sono comparate in termini di sopravvivenza media (o sopravvivenza a 5 anni), la popolazione screenata apparirà avere un miglior risultato anche senza terapia. Tuttavia come mostra la figura la popolazione screenata non vivrà più a lungo ma semplicemente la malattia viene scoperta in un punto più precoce della storia naturale. Lo screening non avrà dato un extra 2 anni di vita in più, ma un extra 2 anni di malattia in più. In studi di efficacia il solo modo per evitare il lead-time bias è di comparare la percentuale di mortalità reale tra screenati e non. La percentuale della mortalità non tiene conto del tempo, mentre le misure surrogate come la sopravvivenza media a 5 anni sono sensibili al passare del tempo dalla diagnosi alla morte.
Clementino Stefanetti
Referenze
1. J Natl Cancer Inst. 2002 Feb 6;94(3):167-73.
http://jnci.oxfordjournals.org/cgi/reprint/94/3/167.pdf
2. Lancet. 2000; 355: 1757-70.