
Allarme (ingiustificato?) sul rischio di infarto miocardico con rosiglitazone

Categoria : metabolismo
Data : 26 maggio 2007
Autore : admin
Intestazione :
Una criticata e criticabile metanalisi del New England Journal of Medicine accende una polemica sulla sicurezza cardiovascolare del rosiglitazone.
Testo :
Per determinare se il rosiglitazone sia o meno associato ad un aumento del rischio di infarto miocardico alcuni ricecatori hanno effettuato una meta-analisi degli RCT pubblicati e non pubblicati presenti nel sito web della ditta produttrice del farmaco e di quelli resi pubblici dalla FDA. Per essere considerati i trials dovevano durare almeno 24 mesi ed avere un gruppo di controllo e dovevano registrare gli infarti miocardici e le morti cardiovascolari. Il pool dei dati ha prodotto un gruppo di 15560 pazienti trattati con rosiglitazone ed un gruppo, definito di "controllo", di 12283 pazienti trattati con placebo o vari farmaci o purché diversi dal rosiglitazone.
Nei 42 trials rivisitati si sono verificati 86 infarti del miocardio nel gruppo trattato con rosiglitazone e 72 nel gruppo controllo (OR 1,43; P = 0,03). Nel gruppo rosiglitazone sono stati rilevati 39 decessi da cause cardiovascolari contro i 22 del gruppo controllo (OR 1,64; p = 0,06). La mortalità per tutte le cause non è risultata significativamente maggiore nel gruppo rosiglitazone (OR 1,18; P = 0,24).
Poiché non vi era evidenza di eterogeneità tra gli studi la meta-analisi è stata effettuata con la tecnica detta fixed-effect model.
Gli autori concludono che il rosiglitazone è associato ad un significativo aumento del rischio di infarto miocardico mentre l'aumento delle morti da cause cardiovascolari non raggiunge la significatività statistica. Tuttavia lo studio è limitato dal fatto che gli autori non hanno potuto avere accesso alle fonti originali.
Fonte:
Nissen SE and Wolski K. Effect of rosiglitazone on the risk of myocardial infarction and death from Cardiovascular Causes. N Engl J Med 2007 Jun 14; 356: 2457-2471.
Commento di Renato Rossi
I glitazoni sono una nuova classe di farmaci usati nel trattamento del diabete tipo 2, il cui meccanismo d'azione consiste nell'aumentare la sensibilità dei tessuti periferici all'insulina. Non è la prima volta che questi farmaci si trovano nell'occhio del ciclone. Alcuni anni fa era stato ritirato il troglitazone a causa della sua tossicità epatica. Più recentemente non era stato approvato il muraglitazar a causa delle preoccupazioni di possibili effetti cardiovascolari [1].
La FDA ha già provveduto ad emanare un
"potential safety issue" [2]. Nel suo sito web scrive testualmente che alcuni dati derivati da trials clinici mostrano un aumento potenzialmente significativo di infarto e decessi cardiovascolari. Tuttavia l'agenzia fa notare che altri dati, pubblicati e non pubblicati, derivanti da trials a lungo termine, inclusa una analisi ad interim dello studio RECORD (un RCT in corso), e una rianalisi non pubblicata dello studio DREAM [3] mostrano dati in contrasto con i precedenti. La FDA assicura che è in corso una rivalutazione completa di tutti i dati disponibili e per ora consiglia i pazienti che assumono rosiglitazone che hanno una cardiopatia o che sono a rischio di infarto di consultare il proprio medico curante onde pesare queste nuove informazioni e le eventuali alternative.
La ditta produttrice del rosiglitazone contesta la meta-analisi del New Englan Journal of Medicine perchè la ritiene incompleta ed effettuata con una metodica che gli stessi autori ammettono avere delle limitazioni. In particolare nel sito web della ditta produttrice viene citato lo studio ADOPT [4] in cui non c'era differenza per quanto riguarda gli eventi cardiovascolari totali tra il rosiglitazone, la metformina e la gliburide. Anche nello studio DREAM [3] non si registrò un aumento degli eventi cardiovascolari con il rosiglitazone. Inoltre il Board indipendente che sta monitorando l'andamento dello studio RECORD non ha trovato motivi per interrompere il trial. Infine un'analisi di un database di più di 33.000 pazienti con diabete, effettuata da ricercatori indipendenti, non ha rilevato differenze per quanto riguarda gli eventi cardiovascolari (compreso l'infarto miocardico) tra rosiglitazone e altri antidiabetici orali.
Che dire? La meta-analisi del New England Journal of Medicine indubbiamente richiama all'attenzione dei medici sul problema della sicurezza dei farmaci. C'è solo da sperare che vengano analizzati compiutamente tutti i dati disponibili: è interesse primario non solo dei pazienti ma anche delle autorità regolatorie e delle stesse ditte che producono i farmaci.
Referenze
1. http://www.pillole.org/public/aspnuke/news.asp?id=2008
2. http://www.fda.gov/bbs/topics/NEWS/2007/NEW01636.html
3. http://www.pillole.org/public/aspnuke/news.asp?id=2729
4. http://www.pillole.org/public/aspnuke/news.asp?id=2946
Commento di Luca Puccetti
L'articolo di Nissen et al. Cleveland Clinic, pubblicato con grande enfasi dal NEJM e l'editoriale di accompagnamento di Bruce Psaty (University di Washington, Seattle) e Curt Furberg (Wake Forest University, Winston-Salem, NC) hanno destato grande clamore essendo stati ripresi dai media con toni apocalittici. Questa amplificazione scandalistica ha gettato nel panico milioni di persone che sono in terapia con il rosiglitazone.
Qual'è il nocciolo del problema ? Si cura il diabete proprio perchè causa infarti e morti cardiovascolari in eccesso, pertanto se un farmaco usato per curare "meglio" il diabete provoca più infarti è ben lungi dal rappresentare un miglioramento nella terapia, nonostante possa far conseguire un miglior controllo del profilo glicemico. La FDA attualmente accetta di registrare un farmaco per il diabete se esso dimostra di controllare l'emoglobina glicata e di non indurre eventi avversi rilevanti. Il razionale è che la diminuzione dell'emoglobina glicata è un indice surrogato attendibile degli eventi. Ovviamente per dimostrare un effetto sugli eventi sono infatti necessari studi molto lunghi e su numeri rilevanti che comporterebbero un ritardo notevole nella disponibilità di nuovi farmaci per una malattia così grave e devastante sia sul paino individuale che sociale. LA FDA pertanto ritiene di poter affidarsi agli effetti sull'emoglobina glicata come indice anticipatorio di un effetto sugli eventi.
I recettori attivati dal proliferatore del perossisoma ( PPAR ) sono fattori di trascrizione nucleare che modulano l’espressione di numerosi geni. Sono stati realizzati farmaci che hanno come target due distinte famiglie di PPAR, PPAR-alfa e PPAR-gamma. Farmaci ad attività sul PPAR-alfa sono i derivati dell’Acido Fibrico, Fenofibrato e Gemfibrozil. Questi farmaci modulano il metabolismo lipidico abbassando i livelli dei trigliceridi e producono modesti aumenti dei livelli di colesterolo HDL. Gli agonisti PPAR-gamma aumentano la sensibilità all’insulina e sono impiegati come farmaci antidiabete. Due farmaci sono attualmente disponibili in clinica, Pioglitazone e Rosiglitazone. Sono in sviluppo agonisti PPAR a duplice azione, sia su PPAR-alfa che su PPAR-gamma. Il primo agonista PPAR a duplice azione che è giunto al vaglio dell’FDA è stato il Muraglitazar, un potente agonista PPAR-gamma con moderati effetti a livello di PPAR-alfa che in una revisione su 2.374 pazienti trattati con Muraglitazar e 1.351 pazienti del gruppo controllo, di cui 823 che hanno assunto Pioglitazone e 528 placebo. ha dimostrato di essere associato con un eccesso di eventi avversi cardiovascolari rispetto ai controlli (1).
I principali studi sul rosiglitazone sono stati l'ADOPT e il DREAM. Lo studio ADOPT (A Diabetes Outcome Progression Trial, 2 ) è un RCT multicentrico su 4360 diabetici di nuova diagnosi randomizzati a ricevere inizialmente rosiglitazone 4 mg/die, o metformina 500 mg/die, o gliburide 2.5 mg/die che sono stati progressivamente aumentati fino a rosiglitazone 4 mg bid, metformina 1 g bid, e gliburide7.5 mg bid nel caso la glicemia basale permanesse elevata. L'end point principale dello studio è stato il tempo dalla randomizzazione al fallimiento terapeutico, (primo episodio di glicemia a digiuno >180 mg/dL). La durata mediana di trattamento è stata di 4 anni.
Il fallimento della monoterapia a 5 anni è stato del 15% nel gruppo rosiglitazone, 21% in quello metformina, e 34% in quello gliburide. In questo studio sono stati segnalati significativi effetti collaterali in particolare, nel gruppo rosiglitazone si è avuto un incremento ponderale medio di 4.8 kg che ha interessato il 7% dei pazienti ed un incremento dei livelli di LDL-colesterolo, un uso più frequente di statine, una maggior frequenza di edema (14%), ed una riduzione dell'ematocrito. Nel gruppo metformina si è osservata un numero (elevato 38%) di eventi avversi gastrointestinali, mentre in quello gliburide aumento di peso ed episodi ipoglicemici (38,7%). Gli eventi cardiovascolari sono stati pari al 4,3% nel gruppo rosiglitazone, 4% in quello metformina e 2,8% in quello gliburide. Il tasso di casi con scompenso cardiaco congestizio non è risultato statisticamente diverso tra il gruppo rosiglitazone (1,5% )e il gruppo metformina (1,3%) ma superiore a quello registrato nel gruppo gliburide (0,6%).
Nello studio DREAM (Diabetes REduction Assessment with ramipril and rosiglitazone Medication) sono stati arruolati 5.269 soggetti (età > 30 anni) senza malattia cardiovascolare, ma con ridotta tolleranza al glucosio oppure con alterata glicemia a digiuno. Secondo un disegno fattoriale 2x2 i pazienti sono stati randomizzati a ricevere ramipril (fino a 15 mg/die) o placebo e rosiglitazone (4 mg/die per i primi 4 mesi e in seguito 8 mg/die) oppure soltanto placebo. Il Follow-up mediano è stato di di 3 anni. L'end-point primario dello studio era lo sviluppo di diabete oppure il decesso. Fra gli outcomes secondari veniva valutata anche la regressione a normoglicemia.
Il braccio dello studio che ha valutato l'effetto del ramipril è stato pubblicato nel NEJM (3), quello che ha valutato il rosiglitazone nel Lancet (4). Nel braccio dello studio che ha valutato l'efficacia di rosiglitazone l'end-point primario è stato osservato nell'11,6% del gruppo rosiglitazone e nel 26,0% del gruppo placebo (HR 0,40; IC95% 0,35-0,46; P < 0,0001). Il 50,5%del gruppo rosiglitazone e il 30,3% del gruppo placebo divenne normoglicemico (HR 1,71; IC95% 1,57-1,87). Gli eventi cardiovascolari furono simili tra i due gruppi (2,9% nel gruppo rosiglitazone e 2,1% nel gruppo placebo; P = 0,08) ma nel gruppo rosiglitazone si osservò una frequenza statisticamente maggiore di scompenso cardiaco (0,5% vs 0,1%; P = 0,01). Nel DREAM trial il rosiglitazone 8 mg/die per 3 anni ha dunque ridotto il rischio di sviluppo di diabete in maniera statisticamente significativa rispetto al placebo: in pratica ogni 1000 pazienti a rischio trattatti con rosiglitazone si prevengono 144 casi nuovi di diabete (NNT = 6,9), inoltre si è associato ad un incremento della probauilità di regressione a normoglicemia. Se si assume che per ogni 20 mg/dl circa di riduzione della glicemia corrisponda una riduzione del rischio cardiovascolare del 20%, i 9 mg/dl della glicemia a digiuno a favore del rosiglitazone si traducono in una riduzione del rischio di poco meno del 9%. Per prevenire un evento cardiovascolare bisognerebbe trattare per 3 anni con rosiglitazone ben 554 soggetti. Non si è evidenziata alcuna differenza significativa per quanto attiene i decessi (1,1% vs 1,3%; P = 0,7) nè per gli eventi cardiovascolari totali (mentre è stato rilevato un aumento del rischio di scompenso cardiaco che passava dallo 0,1% del gruppo placebo allo 0,5% del gruppo rosiglitazone). Proprio per gli effetti avversi sulla ritenzione idrica evidenziati da questi ed altri studi l'American Heart Association/ e l'American Diabetes Association emisero una raccomandazione congiunta in cui si affermava che l'uso dei tiazolidinedioni nei diabetici scompensati in classe NYHA III o IV era controindicato e che era necessaria molta prudenza nei diabetci in classe NYHA I e II. (5). In un RCT su piccoli numeri della durata 52 settimane il rosiglitazone non ha peggiorato rispetto al placebo la funzione cardiaca rilevata mediante ecografia tuttavia si sono avuti più casi di peggiormaneto dell'edema ed un maggior uso di diuretici (6).
Il Rosiglitazone è dunque ben lungi dall'essere un farmaco ideale ed ancora non è ben chiaro quali siano le situazioni cliniche in cui possa conferire dei vantaggi rispetto a terapie consolidate. Ciò detto, tuttavia non possiamo non denunciare le gravissime pecche metodologiche dello studio di Nissen et. al. che hanno effettuato una sorta di "revisione sistematica" di 42 trial comprendenti dati pubblicati e non pubblicati.
La prima errata assunzione è di aver scartato a priori i trials in cui non erano stati rilevati eventi cardiovascolari nel gruppo rosiglitazone o nel gruppo di controllo infatti la mancanza di casi è stata interpretrata come mancanza di rilevamento. E' del tutto ovvio che l'inclusione di questi studi scartati avrebbe cambiato verosimilmente in modo rilevante l'esito dello studio. Tale scelta è talmente temeraria da far indurre al sospetto che ci sia una sorta di volontà prestabilita di giungere ad un determinato risultato che ha "guidato" alcune assunzioni. Il clima di allarme sociale e l'attenzione dei media ed anche del Congresso USA verso gli eventi avversi dei farmaci sono ancora nervi scoperti per le vicende rofecoxib e cerivastatina e dunque l'attenzione rivolta a studi che destano un grande allarme è altissima ed altrettanto grandi sono le probabilità di pubblicare con una notizia "bomba" anche su riviste prestigiose e di passare nei principali media mondiali assicurandosi una notorietà planetaria tanto vasta quanto certa.
Un ulteriore errore molto grave è quello di aver pesato gli studi in base al numero di soggetti inclusi. Questa metodologia può andare bene se gli studi considerati hanno una durata simile, ma in questo caso vi sono piccoli studi di breve durata che pesano quanto studi con numeri enormi e con follow-up lunghi.
La terza grave pecca è la mancanza di dati individuali che preclude alla radice una valutazione accurata e sensata dei dati.
L'editoriale di Psaty e Furberg, anzichè evidenziare i punti deboli dello studio, ha prevalentemente lanciato una sorta di allarme catastrofico che ha amplificato l'effetto scandalistico dell'operazione. Ciò è tanto più vero se si fa riferimento ai numeri assoluti degli eventi in gioco: 86 infarti miocardici e 39 morti cardiovascolari nel gruppo rosiglitazone vs 72 infarti e 22 morti cardiovascolari nel cosiddetto gruppo di controllo che includeva uno zibaldone di trattamenti la cui unica caratteristica unificante era l'essere diversi dal rosiglitazone. Da notare che nessun confronto con singoli comparatori è risultato significativo (vedi tabella), solo mescolando tutti i comparatori assieme, indipendentemente dalla durata degli studi, si raggiunge la significatività statistica per l'infarto miocardico. 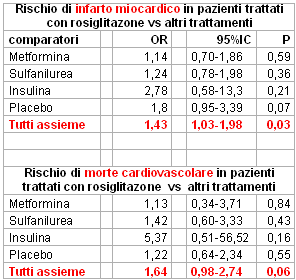
In un editoriale comparso sul Lancet il 23 maggio 2007 (7) si invoca la calma. Si sottolinea che gli studi più attendibili per le decisioni della FDA sono l'ADOPT e il DREAM in cui non si rilevamo differenze significative tra gruppo rosiglitazone e gruppo di controllo per quanto attiene l'incidenza di infarti o di morti cardiovascoalri mentre è evidente un eccesso di episodi di scompenso. Lo stesso editoriale invita ad attendendere i risultati dello studio RECORD, un trial di fase 3 disegnato specificamente per valutare l'impatto cardiovascolare del rosiglitazone, e ad evitare inutili allarmismi. Se lo studio RECORD i cui risultati saranno diponibili nel 2009 avesse dato luogo agli eventi denunciati da Nielsen sarebbe stato già stoppato da un anno, ma Nielsen obietta che lo studio RECORD potrebbe non avere la potenza statistica necessaria a rilevare piccole differenze.
La stessa FDA ha affermato (8) che altri dati in suo possesso, sia pubblicati che non pubblicati che includono un'analisi intermedia dei dati dello studio RECORD nonchè rianalisi non pubblicate dello studio DREAM, forniscono evidenze contraddittorie sul rischio cardiovascolare dei pazienti trattati con rosiglitazone.
L'EMEA ha definito (9) modesto l'incremento di rischio di infarto del miocardio e morte cardiovascolare in pazienti con diabete di tipo 2 trattati con rosiglitazonesenza evidenziare un aumento del rischio di morte per altre cause. L'EMEA ricorda che quando è stato autorizzato per la prima volta in Europa, nel 2000, il rosiglitazone è stato controindicato in pazienti con una storia di insufficienza cardiaca. Da allora il Comitato scientifico europeo per i prodotti medicinali ad uso umano dell’Agenzia Europea dei Medicinali (CHMP) ha posto il rosiglitazone sotto stretta sorveglianza per gli effetti cardiovascolari (insufficienza cardiaca ed altri disturbi cardiaci incluso l’infarto miocardico). La maggior parte degli studi che sono stati inseriti nel New England Journal of Medicine sono già stati valutati dal CHMP. Nel settembre 2006 l’informazione sul prodotto a livello europeo è stata aggiornata con informazioni relative al rischio di eventi di ischemia cardiaca.
Alcuni studi pubblicati nell’articolo del New England Journal of Medicine includevano pazienti che non erano stati trattati secondo le indicazioni approvate. L'EMEA consiglia ai pazienti di non interrompere il trattamento con rosiglitazone e di discutere della terapia con il proprio medico alla prima visita prevista.
In conclusione lo studio recensito ha gravi pecche metodologiche e non dimostra alcunché, ma rappresenta al più uno stimolo ad approfondire l'analisi dei dati ed è pertanto del tutto fuori luogo l'allarme scandalistico che ne è derivato. Se la paventata tossicità coronarica del rosiglitazone è dunque ben lungi dall'essere dimostrata, tuttavia non è affatto chiaro quali siano i vantaggi del farmaco in rapporto agli eventi avversi e pertanto non si può che ribadire l'assoluto impegno a privilegiare gli interventi sullo stile di vita, riservando l'impiego dei farmaci nei casi in cui le modifiche sullo stile di vita non siano state raggiunte o mantenute o non siano sufficienti. Certamente, considerando nel complesso tutti i dati, non si può certo affermare che il rosiglitazone costituisca il farmaco di scelta per il primo impiego nei diabetici. Ulteriori studi sulla sicurezza cardiovascolare e studi "long term" potranno eventualmente chiarire quali siano i casi in cui il farmaco può conferire dei reali vantaggi rispetto a trattamenti alternativi e meno costosi oggi disponibili.
Referenze
1) JAMA. 2005;294:2581-2586
2) N Engl J Med 2006; 355:2427-2443, 2
3) N Engl J Med. 2006 Oct 12; 355:1551-1562
4) Lancet 2006 Sept 23; 368:1096-1105
5) Thiazolidinedione use and congestive heart failure. Circulation. 2003;108:2941
6) J Am Coll Cardiol 2007; 49:1696-704
7) Lancet 2007; DOI:10.1016/S0140-6736(07)60787-9 1.
8) http://www.fda.gov/cder/drug/InfoSheets/HCP/rosiglitazoneHCP.pdf
9) http://www.emea.europa.eu/pdfs/general/direct/pr/23005707en.pdf