
Prasugrel vs clopidogrel nelle sindromi coronariche acute: TRITON–TIMI 38
Categoria : cardiovascolare
Data : 10 febbraio 2008
Autore : admin
Intestazione :
Nei pazienti con sindrome coronarica acuta che devono sottoporsi a PCI, prasugrel + ASA rispetto a clopidogrel + ASA è risultato associato con un minor numero di eventi ischemici ma anche ad un maggior numero di emorragie maggiori e fatali senza differenze in termini di mortalità globale tra i due gruppi.
Testo :
Introduzione
Dopo un evento coronarico l'inibizione piastrinica conferisce vantaggi sensibili in termini di mortalità e morbilità. Attualmente viene abitualmente praticata una doppia inibizione attraverso l'associazione di ASA e di una tienopiridina ossia di una sostanza che previene l'attivazione piastrinica legandosi irreversibilmente al recettore piastrinico P2Y12 ed impedendo la sua attivazione da parte dell'ADP.
Attualmente il farmaco maggiormente impiegato è il clopidogrel, ma alcuni pazienti rispondono in modo inadeguato pertanto sono stati sviluppati altri farmaci allo scopo, uno di questi è il prasugrel, che come il clopidogrel è un profarmaco e che dunque necessita di attivazione in metabolita attivo prima di poter esercitare il suo effetto farmacodinamico.
Teoricamente rispetto al clopidogrel il prasugrel potrebbe giovarsi anche sul piano clinico della maggiore e più riproducibile trasformazione epatica del profarmaco nel metabolita attivo, inducendo un' inibizione dell’aggregazione piastrinica più rapida e pronunciata e con minore variabilità interindividuale.
Allo scopo di valutare comparativamente l'efficacia e la sicurezza di prasugrel + ASA vs clopidogrel+ASA nell'ampio spettro delle sindromi coronariche acute è stato realizzato lo studio TRITON–TIMI 38, realizzato dal TIMI-study group e sponsorizzato da Daiichi Sankyo e Eli Lilly.
Pazienti e Metodi
Sono stati considerati in uno studio randomizzato prospettico in doppio cieco 13608 pazienti con sindrome coronarica acuta che dovevano essere sottoposti a rivascolarizzazione mediante angioplastica percutanea. L’adeguatezza dell’anatomia coronaria per l’intervento di PCI era nota prima della randomizzazione. Questo ha fatto sì che il trattamento in studio sia stato somministrato durante la PCI in 3 pazienti su 4 con una dose di carico (prasugrel a 60-mg e clopidogrel 300-mg). Successivamente i pazienti stati trattati con terapia di mantenimento (prasugrel 10-mg/die o clopidogrel 75-mg) ed ASA (in dose da 75 a 162 mg/die) per 6-15 mesi. La scelta del tipo di vasi da trattare e dei devices da impiantare era liberamente rimessa all'emodinamista.
I principali criteri di esclusione includevano: aumentato rischio emorragico, anemia, trombocitopenia, storia di lesioni intracraniche e l'uso di tienopiridine 5 giorni prima dell'arruolamento.
L'end point principale era rappresentato da un indice combinato che includeva la morte cardiovascoalre, infarto non fatale, e ictus non fatale. Il principale end point di sicurezza era rappresentato dai sanguinamenti maggiori.
Risultati
L' end point principale è stato osservato nel 12.1% dei pazienti del gruppo clopidogrel e nel 9.9% di quelli del gruppo prasugrel (hazard ratio per prasugrel vs. clopidogrel, 0.81; 95% CI, da 0.73 a 0.90; P<0.001), tale differenza è dovuta quasi interamente alla riduzione dell'IMA non fatale senza differenze per quanto attiene alla morte cardiovascolare. È stata osservata una riduzione statisticamente significativa nell’incidenza di IMA seguito da morte per cause cardiovascolari che è stato dello 0,7% nel gruppo clopidogrel e dello 0,4% in quello prasugrel, con una differenza assoluta di 3 morti evitate dal prasugrel per 1000 pazienti trattati.
Nel gruppo prasugrel è stata osservata una riduzione significativa dell'incidenza di infarto miocardico (9.7% per clopidogrel vs. 7.4% per prasugrel; P<0.001), di rivascolarizzazioni urgenti (3.7% vs. 2.5%; P<0.001), di restenosi (2.4% vs. 1.1%; P<0.001).
Sanguinamenti maggiori sono stati osservati nel 2.4% dei pazienti trattati con prasugrel nell' 1.8% di quelli trattati con clopidogrel (hazard ratio, 1.32; 95% CI, da 1.03 a 1.68; P=0.03) con un eccesso assoluto di 6 emorragie maggiori ogni 1000 pazienti trattati. Nel gruppo prasugrel è stato osservato un maggior tasso di emorragie minacciose per la vita (1.4% vs. 0.9%; P=0.01), e di emorragie fatali (0.4% vs. 0.1%; P=0.002), con un eccesso assoluto di 3 eventi ogni 1000 pazienti trattati.
La mortalità per tutte le cause, che non era un end point principale dello studio, non è risultata significativamente diversa nei due gruppi (prasugrel 3% vs clopidogrel 3,2% hazard ratio, 0.95; 95% CI, da 0.78 a 1.16; P=0.64). 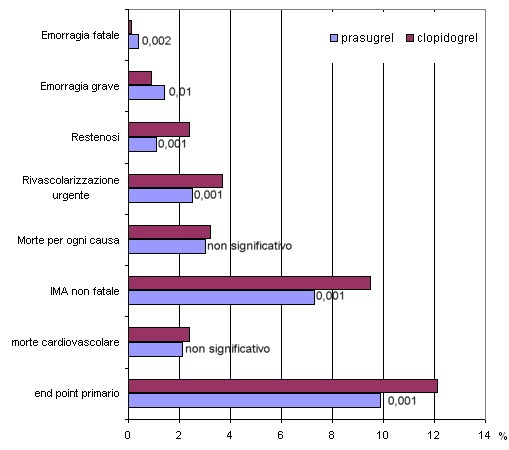
Conclusioni
Gli Autori conludono che nei pazienti con sindrome coronarica acuta che devono sottoporsi a PCI, prasugrel + ASA rispetto a clopidogrel + ASA è risultato associato con un minor numero di eventi ischemici, ma anche ad un maggior numero di emorragie maggiori e fatali senza differenze in termini di mortalità globale tra i due gruppi.
Fonte: NEJM, pubblicato in anticipo on line a www.nejm.org November 4, 2007 (10.1056/NEJMoa0706482)
Commento di Luca Puccetti
Lo studio TRITON–TIMI 38 si è proposto di dare una risposta se una maggiore inibizione dell'attivazione piastrinica comporti dei vantaggi in termini di efficacia e sicurezza rispetto all'attuale standard rappresentato dall'associazione clopidogrel ed ASA.
Dopo una sindrome coronarica acuta esiste un perdurante stimolo protrombotico con generazione di trombina che comporta un rischio aumentato dal 6 all'8 % per anno di recidiva (1). E' pertanto razionale trattare a lungo termine questi pazienti con farmaci che inibiscano la funzione piastrinica oltre a cercare di promuovere miglioramenti nello stile di vita quali la riduzione del peso, la cessazione del fumo, la regolare attività fisica, il controllo dei dismetabolismi ed associando, eventualmente, farmaci stabilizzatori delle placche, quali le statine.
Aspirina
L'aspirina acetila irrevrsibilmente la ciclossigenasi prevendo la formazione di trombossano A2 ed esercita un'azione antiflogistica. Quattro grandi studi (2,3,4,5) realizzati negli anni 70, prima della diffusione dell'angioplastica e del bypass, hanno confermato l'efficacia dell'ASA (somministrata, a seconda del trial, a dosi variabili da 325 a 75 mg/die) rispetto a placebo e la revisione che è stata fatta dal Antithrombotic Trialists’ Collaboration ha osservato una riduzione del 22% dell'indice composito comprendente morte cardiovascolare, IMA, o ictus (13.2% vs. 10.7%, p < 0.0001), della mortalità cardiovascolare del 15% (p < 0.0001) e nei pazienti con angina instabileuna riduzione del 46% degli eventi vascolari (13.3% vs. 8.0%, p < 0.0001)
Tuttavia nonostante i benefici mostrati dall'ASA, la mortalità e morbilità dopo una sindrome coronarica rimangono elevate (7) e questo ha spinto la ricerca al fine di trovare molecole per ridurre questo rischio da usare a breve e a lungo termine, da sole od in associazione all'ASA.
Tienopiridine
Gli antagonisti del recettore dell'ADP, ticlopidina, clopidogrel e prasugrel, agiscono prevenendo la degranulazione piastrinica e la reazione di attivazione piastrinica, inibibendo la trasformazione del recettore GP IIb/IIIa allo stato che lega il fibrinogeno e prevenendo in modo selettivo ed irreversibile il legame dell ADP al recettore piastrinico P2Y12.
La ticlopidina è una molecola attiva mentre clopidogrel e prasugrel sono profarmaci e necessitano pertanto di attivazione in vivo.
La ticlopidina tuttavia agisce lentamente esercitando la sua azione dopo alcuni giorni e pertanto non è utile nel trattamento acuto delle sindromi coronariche, al contrario clopidogrel e prasugrel somministrati in bolo (300 mg o 60 mg, rispettivamente) agiscono rapidamente (8).
Pertanto la ticlopidina sembrebbe dal punto di vista teorico maggiormente indicata nel trattamento dell'angina instabile in cui si è rivelata effettivamente efficace in base ai risultati di un trial randomizzato (9) che ha comparato la ticlopidina con il placebo in 662 pazienti con angina instabile dando luogo ad una riduzione del 46% dell'indice combinato comprendente morte cardiovascolare e IMA (p = 0.009).
Il clopidogrel è stato comparato all'ASA nello studio CAPRIE (10), per la prevenzione secondaria degli eventi ischemici. Rispetto all'ASA ad 1,9 anni di follow-up clopidogrel è risultato associato ad una riduzione dell'end point combinato morte cardiovascoalre, IMA e Ictus ischemico dell' 8.7% (95% CI da 0.3% a 16.5%).
Associazione ASA -Tienopiridine
Poiché ASA e tienopiridine agiscono con meccanismi diversi è stata testata l'ipotesi di associare ASA e una tiendopiridina al fine di ottenere un effetto sinergico vantaggioso nel management della sindrome coronarica.
La prima associazione testata è stata ASA e ticlopidina nei pazienti sottoposti ad angioplastica e posizionamento di stent ed una metanalisi (11) dei vari trials ha dimostrato un vantaggio dell'associazione rispetto alla terapia con la sola ASA nella riduzione della morte cardiovascolare ed dell'IMA non fatale (OR 0.23; 95% CI, da 0.11 a 0.49; p = 0.0001) o rispetto all'associazione aspirina e warfarin (OR, 0.51; 95% CI, da 0.33 a 0.78; p = 0.002).
Lo studio Clopidogrel in Unstable angina Recurrent Events (CURE) è un trial randomizzato e controllato che è stato disegnato per comparare l'effetto dell'aggiunta di clopidogrel ad ASA rispetto ad ASA da sola su un indice combinato che comprendeva morte cardiovascolare, infarto miocardico ed ictus in pazienti con angina instabile od infarto senza sopraslivellamento ST.
Dopo la randomizzazione tutte le procedure erano permesse, senza restrizioni di sorta in merito all'effettuazione di interventi di rivascolarizzazione , l'uso di eparina o di antagonisti GP IIb/IIIa o al tipo di stent da impiantare.
Sono stati reclutati 12652 pazienti di cui 5491 (44%) sono stati sottoposti a studio angiografico, 2072 (16.5%) sono stati trattati con bypass, e 2658 (21.2%) con PCI.
E' stata osservata una riduzione relativa dell'end point primario dell'ordine del 20% (9.3% vs. 11.4%; RRR, 0.80; 95% CI, da 0.72 a 0.90; p = 0.00009) (12), della morte cardiovascolare (5.1% vs. 5.5%; RRR, 0.93) del 14% dell'ictus (1.2% vs. 1.4%; RRR, 0.86), ma soprattutto del reinfarto -23% (5.2% vs. 6.7%; RRR, 0.77). I risultati non sono stati influenzati dal tipo di intervento di rivascolarizzazione effettuato.
Tuttavia, nonostante questi risultati, una percentuale ancora significativa di pazienti va incontro a nuovi eventi dopo una sindrome coronarica acuta.
Questo può essere dovuto a molti fattori. Ad esempio grande importanza hanno avuto gli studi sul tipo di stent impianto nelle PCI. Dovendo riassumere concetti molte volte affrontati da questa testata, alla luce delle attuali evidenze, appare chiaro che gli stent ad eluizione fino ad oggi impiegati risentono molto del tipo di lesioni da trattare e dalla durata della terapia antiaggregante combinata. Alcune evidenze indicano in 24 mesi la durata necessaria di tale terapia.
Accanto ai fattori correlati al tipo di stent impiantato ed alla durata della terapia antiaggregante combinata un ulteriore elemento in grado di influenzare le recidive degli eventi è legato alla variabilità inter e intra-individuale di risposta alla terapia antiaggregante.
Questi elementi hanno costituito la premessa per la ricerca di farmaci non solo più potenti, ma anche con minore variabilità di risposta inter-individuale. Il prasugrel in vitro mostra di possedere una minore variabilità di risposta tra diversi individui ed una riduzione dei soggetti non responder rispetto al clopidogrel (13).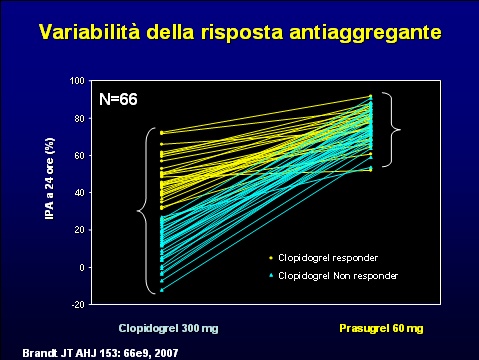
I risultati dello studio TRITON-TIMI 38, che è stato condotto in modo mirabile avendo registrato un numero bassissimo di casi perduti al follow-up, ha dimostrato una maggiore efficacia di prasugrel rispetto a clopidogrel, con un miglioramento significativo dell'indice combinato. Questo risultato comporta un maggior numero di emorragie gravi, tanto che la mortalità per tutte le cause non è significativamente diversa tra i pazienti trattati con clopidogrel o prasugrel. Per ogni 1000 pazienti trattati con prasugrel vs clopidogrel si osservano 22 pazienti in meno con sindrome coronarica acuta e 5 pazienti in più con emorragie maggiori non correlate alla rivascolarizzazione chirurgica.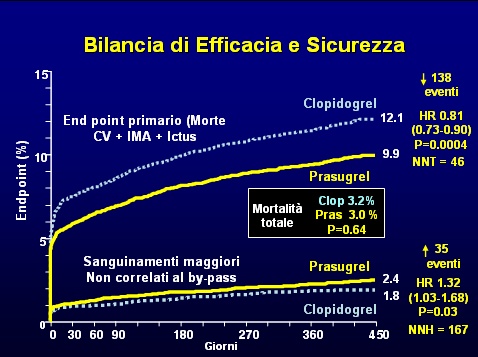
Come osservato dal Professor Carlo Patrono (17) lo studio presenta criteri di inclusione ed esclusione tali da aver selezionato pazienti ad elevato rischio ischemico e basso rischio emorragico , ossia uno scenario favorevole alle caratteristiche del prasugrel e dunque possono sorgere dubbi circa la trasferibilità dei risultati di efficacia ad una popolazione non così selezionata, ossia a maggior rischio emorragico e a minor rischio ischemico.
E' necessario inoltre ricordare che la mortalità non era un end point primario dello studio e dunque correttamente è doveroso ragionare prioritariamente sull'indice combinato di efficacia e sull'indice di tollerabilità, ossia sugli outcomes primari predefiniti. Dal punto di vista speculativo, pur con tutte le doverose precauzioni da riservare alle analisi post-hoc, è interessante notare che la scelta del farmaco da usare potrebbe essere indirizzata da una valutazione del profilo di rischio ischemico del paziente rapportato a quello emorragico. Infatti i pazienti diabetici, un subset a particolare rischio ischemico, sembrano avere un beneficio col prasugrel, mentre i pazienti molto anziani ed i soggetti con precedenti vascolari cerebrali presentano maggiori benefici con il clopidogrel.
Sulla base di queste speculazioni gli autori dello studio e l'autore dell'editoriale di accompagnamento (18) enfatizzano la necessità di valutare sia il rischio cardiovascolare che il rischio emorragico del singolo paziente, ai fini di una scelta individualizzata della terapia antitrombotica più adeguata. 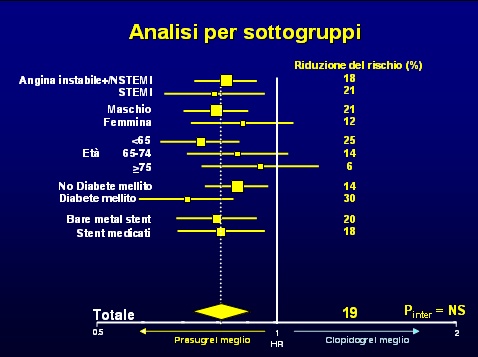
Naturalmente le risultanze delle analisi post hoc dovranno essere confermati da studi specificamente disegnati a questo scopo e sarebbe necessario altresì sviluppare algoritmi predittivi del rischio emorragico, oggi sostanzialmente inesistenti (17).
Al momento questa sembra tuttavia la prospettiva più performante per trattare le sindromi coronariche acute senza sopraslivellamento del tratto ST poichè gli antagonisti orali della GP IIb/IIIa in una metanalisi hanno dato luogo ad un 37% (p = 0.001) di aumento della mortalità. (14)
Invece l'aggiunta di clopidogrel ad ASA produce vantaggi marginali nell'infarto con elevazione del tratto ST che sono stati documentati solo a breve termine.
Lo studio COMMIT (15), un trial, randomizzato in doppio cieco, condotto su circa 45.000 pazienti, ricoverati per sospetto infarto del miocardio e che non erano stati sottoposti ad angioplastica come trattamento di prima scelta sono stati randomizzati a clopidogrel+aspirina o aspirina+placebo, terapie prescritte fino alla dimissione dall’ospedale o per 4 settimane, in aggiunta ai trattamenti usuali.
L’aggiunta del clopidogrel all’aspirina ha ridotto significativamente la mortalità complessiva a 15 giorni (durata media del trattamento). Sono stati riscontrati circa 5 decessi in meno per 1000 pazienti trattati e nessun incremento di emorragie gravi, ma non è noto se questi effetti benefici sulla sopravvivenza persistano nel tempo (16).
Un'ulteriore possibile strategia per aumentare l'efficacia potrebbe essere quella di impiegare dosi più elevate di clopidogrel invece che di usare il prasugrel. Una delle critiche avanzate allo studio TRITON-TIMI 38 era propio la dose subottimale di clopidogrel usata. Occorre dire che queste critiche si basano più su presunzioni che su dati certi dal momento solo piccoli studi avrebbero mostrato un vantaggio della dose di carico di 600 mg di clopidogrel rispetto a dosi minori ed occorre attendere per avere risposte in merito i risultati dello studio OASIS 7.
I risultati dello studio PRINCIPLE-TIMI 44 (19) dimostrano come anche una dose doppia di clopidogrel rispetto a quella adoperata nello studio TRITON-TIMI 38 non raggiunga lo stesso effetto inibitorio sull’aggregazione piastrinica da ADP del prasugrel, per una verosimile saturabilità della formazione del metabolita attivo del clopidogrel a livelli insufficienti per inattivare completamente il recettore P2Y12 (17).
Lo studio PRINCIPLE-TIMI 44 (19) è un trial randomizzato, doppio cieco che intende comparare l'effetto inibitorio sull'aggregazione piastrinica indotta da ADP di prasugrel rispetto ad alte dosi di clopidogrel in pazienti che devono effettuare una PCI . Lo studio si articola in due fasi, nella prima 201 pazienti sono stati randomizzati a clopidogrel 600 mg o prasugrel 60 mg circa un'ora prima della coronarografia. L' end point primario di questa prima parte dello studio era l'inibizione dell'aggregazione piastrinica, indotta da 20-µmol/L di ADP, misurata a sei ore dal carico. Dopo la PCI i pazienti sono stati trattati con dosi di mantenimanto di prasugrel 10 mg/die o clopidogrel 150 mg/die. Dopo14 giorni è stata misurata l' inibizione dell'aggregazione piastrinica, successivamente i pazienti sono stati sottoposti a crossover e nuovamente dopo ulteriori 14 giorni è stata misurata l'inibizione dell'aggregazione piastrinica. I risultati mostrano una maggiore inibizione dell' aggregazione piastrinica con il prasugrel rispetto a clopidogrel, sia a 6 ore dal carico ( 74,8% vs 31,8% p < 0,0001), che nella fase di mantenimento (61,3% vs 46,1% p < 0,0001).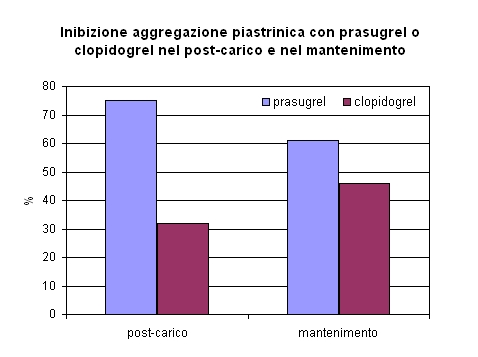
Nello studio TRITON-TIMI 38 è stato inoltre registrato un apparente aumento di cancro del colon che necessita di ulteriori valutazioni nell'ambito del processo registrativo e di sorveglianza post-marketing.
Il 26 Dicembre 2007 prasugrel è stato sottoposto alla FDa per l'approvazione. Se l'iter registrativo non subirà sorprese il prasugrel potrebbe rappresentare un vantaggio per i pazienti con sindromi coronariche acute se usato coerentemente ad un'individualizzazione della terapia antitrombotica mediante la valutazione comparata del profilo di rischio trombotico ed emorragico del singolo paziente.
Referenze
1) Eur Heart J. 2000;21:247
2) N Engl J Med. 1983;309:396–403
3) N Engl J Med. 1985;313:1369–1375
4) N Engl J Med. 1988;319:1105–1111
5) Lancet. 1990;336:827–830
6) BMJ. 2002;324:71–86
7) Eur Heart J. 2000;21:1473–1481
8) Cardiovasc Drug Rev. 1993;11:180–198
9) Circulation. 1990;82:17–26
10) Lancet. 1996;348:1329–1339
11) Eur Heart J. 2000;21:2033–2041
12) N Engl J Med. 2001;345:494–502
13) Brandt JT AHJ 153: 66e9, 2007
14) Circulation. 2001;103:201–206
15) Lancet 2005; 366: 1607-21
16) Prescrire Int 2006; 15: 194
17) http://www.pharmtox.org/sif/ricerca/trials_clinici_sif.php
18) N Engl J Med 2007; 357:2078-81
19) Wiviott et al., Circulation, in press