
Etanercept per il trattamento della psoriasi a placche nei bambini
Categoria : dermatologia
Data : 01 ottobre 2008
Autore : admin
Intestazione :
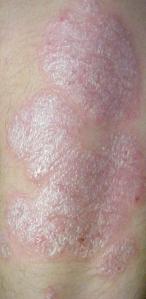
Etanercept dopo 2 settimane di trattamento si associa ad una una riduzione statisticamente e clinicamente significativa della psoriasi a placche in bambini e adolescenti.
Testo :
L’FDA non ha ancora autorizzato nessuna terapia sistemica per il trattamento della psoriasi nei bambini e negli adolescenti; la fototerapia e le terapie sistemiche hanno un uso limitato a causa della bassa tollerabilità nei bambini, degli effetti collaterali cumulativi, e della teratogenicità. Lo studio progettato dalla Immunex, casa produttrice del farmaco, in collaborazione con l’Etanercept Pediatric Psoriasis Study Group, ha lo scopo di valutare efficacia e sicurezza dell’etanercept nel trattamento di adulti e adolescenti con psoriasi a placche da moderata a severa (*). L’etanercept è un recettore solubile del Tumor Necrosis Factor (TNF)-a, che antagonizza gli effetti del TNF-a endogeno e che si è dimostrato efficace nel trattamento della psoriasi negli adulti.
È uno studio di fase III, della durata di 48 settimane, multicentrico (42 centri statunitensi e canadesi) randomizato, in doppio cieco, contro placebo. Sono stati inclusi pazienti di età compresa tra i 4 e i 17 anni, affetti da psoriasi a placche stabile da moderata a grave (punteggio =12, secondo lo Psoriasi Area-and-Severity Index - PASI), in cui la psoriasi interessava almeno il 10% della superficie del corpo e durava da almeno 6 mesi, in trattamento in atto o pregresso con fototerapia o terapia sistemica (metotrexato, ciclosporina o retinoidi), o nei quali la psoriasi era stata considerata dai ricercatori poco controllata dalla terapia topica. Criteri di esclusione erano: pregressa terapia con agenti anti-TNF-a; trattamento con psoraleni e raggi ultravioletti A (PUVA), con raggi ultravioletti A e B, con farmaci sistemici per la psoriasi, corticosteroidi orali o parenterali, corticosteroidi topici, preparazioni topiche a base di analoghi della vitamina A o D, antralina, inibitori della calcineurina nei 14 giorni precedenti l’inizio dello studio e trattamento con agenti biologici nei 30 giorni precedenti l’inizio dello studio. Era consentita l’applicazione topica di steroidi, di potenza bassa o moderata, su cuoio capelluto, ascelle o inguine.
Lo studio prevedeva 3 fasi: 1) 12 settimane in cui 211 pazienti, reclutati tra l’8 settembre 2004 e il 29 novembre 2005, sono stati randomizzati in doppio cieco, a ricevere 1 iniezione sottocutanea settimanale di placebo o etanercept 0,8 mg/kg, fino ad un massimo di 50 mg (**), per stabilirne l’efficacia vs placebo; 2) 24 settimane in aperto con la somministrazione, 1 volta la settimana, di etanercept per valutarne l’efficacia in tutti i pazienti; 3) dalla settimana 36 alla 48, 138 pazienti sono stati nuovamente randomizzati a placebo o etanercept, per valutare gli effetti della sospensione del farmaco e della sua successiva risomministrazione.
End point primario è stato il miglioramento di almeno il 75% del punteggio PASI (PASI 75) alla settimana 12; endpoint secondari sono stati il PASI 50, PASI 90, una valutazione globale del medico sulle placche psoriatiche (“clear” o “almost clear”, punteggio 0 o 1) e la risposta al Children’s Dermatology Life Qualità Index (CDLQI) alla settimana 12. Altre misure di efficacia sono state rilevate alle settimane 2, 4, 8, 16 e successivamente ogni 4 settimane.
Gli end point di sicurezza hanno incluso effetti avversi inclusi quelli gravi, infezioni di ogni gravità, reazioni al sito di iniezione, tumori, esami di laboratorio, livelli plasmatici di etanercept, “rebound” della malattia durante il periodo di sospensione del trattamento (definito come un peggioramento =125% del punteggio PASI rispetto ai livelli basali nei tre mesi successivi alla sospensione del farmaco).
I pazienti inclusi nello studio presentavano caratteristiche demografiche e anamnestiche simili, il 75% erano bianchi, l’età media era di 13 anni, e il 36% di età =11 anni.
Alla settimana 12, il 57% del gruppo etanercept e l’11% del gruppo placebo (p<0,001) hanno raggiunto l’end point primario, ma una differenza significativa era già rilevabile dopo 4 settimane.
Gli end point secondari di PASI 50, PASI 90, e la valutazione globale del medico “clear” o “almost clear” sono stati raggiunti da una più ampia percentuale di pazienti trattati con etanercept (rispettivamente 75%, 27%, 53%) che con placebo (23%, 7% e 13%; p<0,001). Non si sono verificate gravi reazioni avverse.
Durante la fase in aperto, il 62% del gruppo che inizialmente riceveva placebo e il 69% del gruppo inizialmente trattato con etanercept ha raggiunto il PASI 75 alla settimana 24, e la risposta è stata mantenuta fino alla settimana 36 (65% vs 68%, etanercept vs placebo). La percentuale di pazienti che ha raggiunto PASI 50 e PASI 90 alle settimane 24 e 36 rispetto a quella che aveva raggiunto i due end point alla settimana 12, è risultata maggiore per entrambi i gruppi.
Quattro gravi reazioni avverse si sono manifestate in 3 pazienti durante la somministrazione in aperto di etanercept: in una paziente di 14 anni è stato necessario interrompere la terapia a causa di comparsa di una cisti ovarica; in un paziente di 9 anni si sono manifestate infezioni sotto forma di gravi episodi di gastroenterite con conseguente disidratazione, che hanno richiesto il ricovero ospedaliero, ma non la sospensione del trattamento; in un paziente di 7 anni con anamnesi di asma, si è manifestata una polmonite basilare sinistra, che ha richiesto la somministrazione di antibiotici i.v. e l’interruzione del trattamento con etanercept.
Tra le settimane 36 e 48, il 42% (29/69) dei soggetti assegnati a placebo alla seconda randomizzazione non era più responsivo ed è stato nuovamente trattato con etanercept; dopo 4-8 settimane di ritrattamento, la risposta è stata comparabile a quella ottenuta nella fase in doppio cieco nei pazienti che avevano ricevuto il farmaco per la stessa durata di terapia.
Durante il periodo di sospensione-ritrattamento, non si sono verificati fenomeni di rebound o variazioni morfologiche della psoriasi, solo un paziente ha interrotto lo studio, durante la fase in aperto, a causa del peggioramento della malattia.
Lo studio dimostra una riduzione statisticamente e clinicamente significativa della psoriasi a placche da moderata a grave in bambini e adolescenti in seguito alla somministrazione di etanercept 0,8 mg/kg/settimana, già dopo 2 settimane di trattamento.
La risposta all’etanercept è ritenuta indicativa del coinvolgimento del TNF-a nella patogenesi della psoriasi in età pediatrica.
Dott.ssa Arianna Carolina Rosa
(*) L’etanercept, in Italia con il nome commerciale Enbrel®, è un farmaco in classe H OSP 2; è approvato per il trattamento dell’artrite reumatoide, artrite giovanile poliarticolare idiopatica, artrite psoriasica, spondilite anchilosante, e presenta un specifica indicazione per la psoriasi a placche da moderata a severa negli adulti che non hanno risposto, o presentano una controindicazione, o sono intolleranti, ad altre terapie sistemiche, inclusi ciclosporina metotrexato e PUVA.
(**) La posologia utilizzata nello studio è conforme a quella approvata per il trattamento dell’artrite giovanile poliarticolare idiopatica, unica indicazione pediatrica (4-17 anni) approvata per questo farmaco.
Fonte: N Engl J Med 2008; 358: 241-51.
Contributo gentilmente concesso dal Centro di Informazione sul Farmaco della Società Italiana di Farmacologia - http://www.sifweb.org/farmaci/info_farmaci.php/