
Trombosi e cancro
Categoria : oncologia
Data : 08 agosto 2010
Autore : admin
Intestazione :
Gli studi e le revisioni sistematiche sembrano suggerire un effetto positivo della terapia anticoagulante nel prolungare la sopravvivenza dei pazienti affetti da cancro, ma non ci sono ancora evidenze definite a riguardo.
Testo :
I pazienti con cancro hanno un aumentato rischio di Trombosi (1) e i pazienti con una diagnosi di Trombosi Venosa Profonda spontanea senza cause apparenti hanno un rischio aumentato di sviluppare un cancro entro un anno. L’incidenza varia a seconda degli studi dal 2% al 25%. (2,3) La Trombosi è la seconda causa di morte in pazienti con cancro. L’incidenza di trombosi dipende dal tipo di cancro. (4) 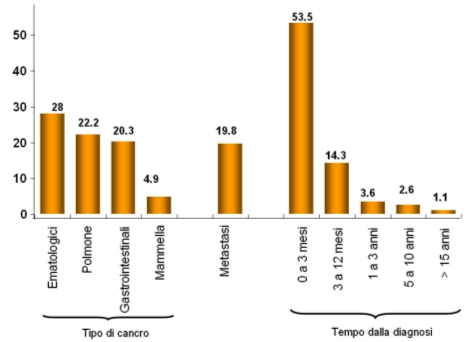
Figura1. Rischio di Trombosi venosa in caso di cancro (4)
Diversi studi hanno dimostrato l’efficacia degli anticoagulanti nel prolungare la sopravvivenza. Una meta-analisi di soli RCT (5) del 2005 ha dimostrato un aumento della sopravvivenza solo per le EBPM ma non per gli anticoagulanti orali. Il rischio emorragico era simile al placebo per le EBPM mentre era molto elevato per gli anticoagulanti orali. Date queste premesse sorgono spontanee due domande:
1.in caso di TVP senza apparenti cause scatenanti è opportuno eseguire uno screening tumorale?
2.in caso di neoplasia avanzata è opportuno trattare i pazienti con EBPM?
Alla prima domanda diversi studi prospettici e randomizzati hanno dimostrano l’utilità dello screening nel diagnosticare un cancro occulto (6,7) ma non hanno ancora risposto alla domanda se tutto ciò porta ad un miglioramento della prognosi e ad un aumento della sopravvivenza. Due studi prospettici hanno cercato di rispondere alla domanda. (6,8) Interessante lo studio SOMIT (6) in cui lo screening aggressivo ha portato alla scoperta di cancri in fase precoce con una riduzione del ritardo diagnostico da 11,6 mesi a 1 mese. La mortalità da cancro si è verificato in 2 (2%) pazienti del gruppo dello screening e in 4 (3,9%) del gruppo di controllo con una differenza assoluta del 1.9% (IC 95%, 5.5–10.9%). Da notare, sottolineato dagli stessi Autori, la scarsa numerosità del campione (99 del gruppo screening vs 102 del gruppo di controllo) e di eventi.
Cosa dicono le Linee Guida
Le recenti LG Italiane dell’AIOM (Associazione Italiana di Oncologia Medica) riconoscono che lo screening può essere utile nel diagnosticare un cancro occulto ma mancano dati definitivi sulla reale utilità in termini di sopravvivenza (9) Pertanto la decisione è lasciata al Medico che deciderà in base al caso clinico.
Le LG ESMO (European Society for Medical Oncology) (10) consigliano visita medica, Rx Torace, sangue occulto, visita ginecologica e urologica nell’uomo lasciando esami più costosi come TAC, Endoscopia digestiva e markers tumorali solo in caso di forte sospetto.
In caso di TVP idiopatica la ricerca di una eventuale neoplasia è utile, in termini di sopravvivenza, ai soggetti veramente asintomatici mentre nei casi con sintomi, quali febbre, calo ponderale, astenia, anemia ecc, è probabile che il tumore sia già in fase avanzata. In questi casi l’utilità di eseguire uno screening dipende dalla presenza di comorbidità, tali da precludere ogni intervento. Gli esami più performanti sono la TAC addome e torace con mdc + colonscopia, ma una Ecografia dell’addome completo + una radiografia del torace e ricerca di sangue occulto fecale possono essere sufficientemente cost-effective.
La risposta alla seconda domanda è più difficile. In letteratura si trovano due revisioni sistematiche della Cochrane (11,12) dove si dimostra l’utilità e la sicurezza delle EBPM nel prolungare la sopravvivenza (outcome primario) in pazienti con cancro che non avevano indicazione alla tromboprofilassi. (11,13) Questo effetto non è presente nelle neoplasie in fase avanzata con fallimento delle terapie convenzionali. La seconda Cochrane ha confrontato le EBPM con gli anticoagulanti orali mostrando la maggior efficacia delle prime nel diminuire gli episodi trombotici ma non la diminuzione della mortalità. (12)
Cosa dicono le Linee Guida
Le recenti Linee Guida AIOM (9) passano in rassegna le principali problematiche.
1. Profilassi della trombosi postoperatoria
Dosi profilattiche da mantenere per almeno 1 settimana dopo l’intervento o fino alla dimissione ma tenendo presente che la estensione fino ad un mese riduce il rischio di Trombosi Venose Profonde del 53% (dal 12.6% al 5.9%), mentre l’incidenza di Trombosi Venose Prossimali viene ridotta del 75% (dal 4.9% all’1.2%) rispetto al gruppo di controllo. (15,16)
2. Profilassi della trombosi in corso di chemioterapia e ormonoterapia
Non esistono meta-analisi o revisioni sistematiche e gli studi portati a termine danno risultati contrastanti come il TOPIC 1 e 2 (17) con esiti negativi ma con numero di arruolati ed eventi insufficienti mentre lo studio più grosso, il PROTECHT, con 1200 pazienti ha dato risultati positivi in termini di riduzione della TVP ed Embolia Polmonare dal 3,9% al 2,0% e i dati sono molto più consistenti per i tumori del polmone e del tratto gastrointestinale mentre sono risultati inaspettatamente bassi per i tumori della mammella e ovario. (18) Un recente modello predittivo per individuare i pazienti che gioverebbero della profilassi con EBPM è stato sviluppato da Khorana (19) che consiste in un punteggio per ogni fattore di rischio.
• Sede del cancro (2 punti per quelli a rischio molto alto, stomaco e pancreas, 1 punto per quelli ad alto rischio, linfoma, genitourinari, escluso prostata, e ginecologici). I tumori della mammella, testa/collo e colo-rettali sono considerati a basso rischio.
• Conta Piastrine > di 350.000 mm3 (1 punto).
• Emoglobina < a 10 g/dL e/o uso di stimolanti l’Eritropoiesi (1 punto).
• Conta dei Leucociti > di 11.000 mm3 (1 punto).
• BMI > di 35 kg/m2 (1 punto).
Il rischio di Trombosi durante una mediana di 2,5 mesi è del 0,3% per punteggio di 0 (rischio basso), 2% per un punteggio di 1 o 2 (rischio intermedio) e 6,7% per un punteggio uguale o superiore a 3 (rischio alto). E' da notare che nello studio non c’erano sufficienti casi di tumori renali, cerebrali e mieloma che sono considerati ad alto rischio di Trombosi.
3. Profilassi delle trombosi da catetere
Non Raccomandata la profilassi antitrombotica
4. Profilassi nel paziente medico Ospedalizzato per evento medico acuto
Raccomandata in tutti i pazienti
5. Profilassi nel paziente ambulatoriale
Non raccomandata salvo in caso di Mieloma in trattamento con Talidomide/lenalidomide in combinazione.
Sulla stessa linea sono le Linee Guida ASCO (14) e ESMO (10) entrambe del 2009.
Gli studi e le revisioni sistematiche “sembrano suggerire” un effetto positivo della terapia anticoagulante nel prolungare la sopravvivenza dei pazienti affetti da cancro che sembra indipendente dalla prevenzione delle TVP ed EP ma non ci sono ancora evidenze definite a riguardo.
Le aree di incertezza riguardano quali tipi di tumori e quali pazienti beneficeranno della terapia anticoagulante.
Clementino Stefanetti
Bibliografia
1. White RH, Chew HK, Zhou H, et al. Incidence of venous thromboembolism in the year before the diagnosis of cancer in 528,693 adults. Arch Intern Med. 2005;165:1782–1787.
http://archinte.ama-assn.org/cgi/reprint/165/15/1782.pdf
2.Prandoni P. Deep-vein thrombosis and the incidence of subsequent symptomatic cancer. N Engl J Med. 1992;327:1128–1133.
3. Prandoni P, Piccioli A. Thrombosis as a harbinger of cancer. Curr Opin Hematol. 2006 Sep;13(5):362-5.
4.Blom JW. Malignancies, prothrombotic mutations, and the risk of venous thrombosis. JAMA. 2005 Feb 9;293(6):715-22.
http://jama.ama-assn.org/cgi/reprint/293/6/715.pdf
5.Kuderer NM. A meta-analysis and systematic review of the efficacy and safety of anticoagulants as cancer treatment: impact on survival and bleeding complications. Cancer. 2007;110:1149-61.
http://www3.interscience.wiley.com/cgi-bin/fulltext/114293259/PDFSTART
6.Piccioli A; SOMIT Investigators Group. Extensive screening for occult malignant disease in idiopathic venous thromboembolism: a prospective randomized clinical trial. J Thromb Haemost. 2004 Jun;2(6):884-9.
http://www3.interscience.wiley.com/cgi-bin/fulltext/118817771/PDFSTART
7.Kelly J. Occult cancer in older patients presenting with venous thromboembolism.
Age Ageing. 2002 Mar;31(2):101-4.
http://ageing.oxfordjournals.org/cgi/reprint/31/2/101.pdf
8. Monreal M. Screening for occult cancer in patients with acute venous thromboembolism. J Thromb Haemost. 2005 Nov;3(11):2389-90.
http://www3.interscience.wiley.com/cgi-bin/fulltext/118716750/PDFSTART
9.Linee Guida AIOM 2009. http://urlin.it/17079
10. Linee Guida ESMO 2009 http://annonc.oxfordjournals.org/cgi/reprint/20/suppl_4/iv182.pdf
11. Akl EA. Parenteral anticoagulation for prolonging survival in patients with cancer who have no other indication for anticoagulation. Cochrane Database Syst Rev. 2007 Jul 18;(3)
12. Akl EA.Oral anticoagulation for prolonging survival in patients with cancer. Cochrane Database Syst Rev. 2007 Apr 18;(2)
13. Klerk CP. The effect of low molecular weight heparin on survival in patients with advanced malignancy. J Clin Oncol. 2005 Apr 1;23(10):2130-5.
http://jco.ascopubs.org/cgi/reprint/23/10/2130.pdf
14.Linee Guida ASCO. J Clin Oncol. 2007 Dec 1;25(34):5490-505.
http://jco.ascopubs.org/cgi/reprint/25/34/5490.pdf
15. Bergqvist D, Agnelli G, Cohen AT, et al. Duration of prophylaxis against venous thromboembolism with enoxaparin after surgery for cancer. N Engl J Med 2002; 346:975-80.
http://content.nejm.org/cgi/reprint/346/13/975.pdf
16. Bottaro FJ, Elizondo MC, Doti C, et al. Efficay of estende thrombo-prophylaxis in major abdominal surgery: what does the evidence show? A meta-analysis Throm Haemost 2008; 99: 1104-1111.
17.Haas SK, Kakkar ak, Kemkes-Matthes B, et al. Prevention of venous thromboembolism with low molecular weight heparin in patients with metastatic breast or lung cancer- results of the TOPIC studies. J Thromb Haemost 2005; 3 (Suppl 1: abstract OR059.
18. Agnelli G, Gussoni G, Bianchini C, et al. Nadroparin for the prevention of thromboembolic events in ambulatory patients with metastatic or locally advanced solid cancer receiving chemotherapy: a randomised, placebo-controlled, double-blind study. Lancet Oncol epub 2009
19.Khorana AA. Development and validation of a predictive model for chemotherapy-associated thrombosis. Blood. 2008 May 15;111(10):4902-7.
http://bloodjournal.hematologylibrary.org/cgi/reprint/111/10/4902.pdf